Artigos Originais
Dengue, Chikungunya e vírus Zika na Região Sul do Brasil
Dengue, Chikungunya and Zika virus in the Southern Region of Brazil
Dengue, Chikungunya y virus Zika en la Región Sur de Brasil
Dengue, Chikungunya e vírus Zika na Região Sul do Brasil
Vértices (Campos dos Goitacazes), vol. 20, núm. 1, 2018
Instituto Federal de Educação, Ciência e Tecnologia Fluminense

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 22 Noviembre 2017
Aprobación: 23 Enero 2018
Resumo: Os estudos biogeográficos correlacionados a geografia da saúde estão cotidianamente sendo ampliados para as mais diversas temáticas, principalmente para os estudos do Aedes aegypti como vetor. O objetivo deste trabalho é demonstrar os casos do dengue, chikungunya, nos estados do Paraná, Santa Catarina e Rio Grande do Sul, nos anos de 2015 e 2016, e, do vírus Zika em 2016. A partir dos resultados, foi possível demonstrar a incidência e o aumento dos casos no período estudado. Sugere-se necessário o aumento de campanhas por parte do governo e intensificação dos cuidados com a água parada, principalmente pela população, ao longo do ano.
Palavras-chave: Vetor, Geografia da Saúde, Região Sul do Brasil.
Abstract: Biographical studies correlated to health geography are constantly expanded to the most diverse themes, especially to the studies of Aedes aegypti as a vector. This study aims to demonstrate the cases of dengue and chikungunya in the states of Paraná, Santa Catarina and Rio Grande do Sul in 2015 and 2016, and of Zika virus in 2016. From the results, it was possible to demonstrate the incidence and the increase of cases in that period. We suggest the increase of governmental dengue prevention campaign and more public concern about stagnant water throughout the year.
Keywords: Vector, Health geography, Brazilian South Region.
Resumen: Los estudios biogeográficos correlacionados a la geografía de la salud se están ampliando para las más diversas temáticas, principalmente para los estudios del Aedes aegypti como vector. El objetivo de este trabajo es demostrar los casos del dengue y chikungunya, en los estados de Paraná, Santa Catarina y Rio Grande do Sul, en los años 2015 y 2016, y del virus Zika en 2016. A partir de los resultados, fue posible demostrar la incidencia y el incremento de los casos en el período estudiado. Se sugiere necesario el aumento de campañas por parte del gobierno e intensificación de los cuidados con el agua parada, principalmente por la población, a lo largo del año.
Palabras clave: Vector, Geografía de la Salud, Región Sur de Brasil.
1 Introdução
A Biogeografia é uma ciência que busca compreender, entre outros aspectos, as localidades de ocorrências onde os organismos estão (LÖWENBERG NETO, 2007), podendo ser fauna ou flora. No presente estudo elencou-se o vetor Aedes aegypti e as patologias que são transmissíveis aos seres humanos.
Os casos do dengue, chikungunya e vírus Zika estão espalhados pelo Brasil e cotidianamente se disseminando para novas localidades dentro das unidades federativas por fatores climáticos que favorecem a reprodução, e pela falta de conscientização da massa da população, pois os cuidados contra o Aedes aegypti devem ocorrer durante todo o ano e principalmente nas estações de primavera e no verão.
Ante o exposto, este trabalho tem por objetivo demonstrar os casos do dengue, e chikungunya nos Estados do Paraná, Santa Catarina e Rio Grande do Sul, nos anos de 2015 e 2016; e do vírus Zika em 2016, assim como os casos graves de dengue e casos com sinais de alarme no período de 2015 e 2016, na Região Sul do país.
2 Etiologia do Dengue
O dengue caracteriza-se como uma arbovirose de rápida propagação em áreas tropicais e subtropicais (DEGENER et al., 2014). A transmissão ocorre aos seres humanos através da picada de mosquitos Aedes aegypti. De acordo com os estudos de Gubler (2004), entre as arboviroses existentes até o momento, o dengue é a única completamente adaptada aos seres humanos, principalmente em áreas urbanas.
O agente da doença é o dengue vírus (DENV), cujo gênero é Flavivirus, família Flaviviridae. Eles possuem quatro sorotipos (DENV-1, DENV-2, DENV-3, DENV-4), que causam o Dengue Clássico (DC) como também a Febre Hemorrágica do Dengue (FHD) (GUBLER, 1997; OMS, 1999; TAUIL, 2001). Normile (2013) descreve a descoberta do sorotipo DENV-5, como uma forma grave de dengue que foi isolada resultante do soro de um paciente. Acredita-se que não há transmissão entre humanos até o momento e que este vírus circula somente entre os primatas.
Quanto ao DENV-1, 2, 3 e 4, Gubler (1998) afirma que as infecções por cada um desses sorotipos certificam imunidade permanente para aquele determinado vírus e transitória para os outros, podendo uma pessoa ser infectada durante a vida por até quatro vezes.
A Organização Mundial da Saúde (OMS) estabelece critérios para a classificação dos casos de dengue, de acordo com a gravidade. No ano de 1997, foi proposta a seguinte classificação para os casos de Dengue: Dengue Clássico (DC); Febre Hemorrágica do Dengue (FHD), que é caracterizada por derrames plasmáticos, manifestações hemorrágicas, insuficiência circulatória e hepatomegalia; e Síndrome do Choque da Dengue (SCD), caracterizada pela insuficiência circulatória. Em 2009, a OMS promoveu a modificação da classificação para: Dengue, Dengue com Sinais de Alarme (DSA) e Dengue Grave (DG), essa última é caracterizada quando ocorre o extravasamento plasmático, grave disfunção de órgãos e sangramento importante (RANGA et al., 1997; WHO, 2009).
De acordo com os estudos de Osanai et al. (1983), o primeiro surto do dengue no século XX no Brasil, teve como sorotipos DENV-1 e DENV-4, na cidade de Boa Vista-RO, no início da década de 80 do século passado.
Em 1986 a doença eclode no Rio de Janeiro (SCHATZMAYR et al., 1986), continuando os números de casos a crescer, concomitantes à evolução e adaptabilidade do dengue ao meio urbano. Fraiha (1968)1 apud Bassi et al. (2011) complementa afirmando que no estado do Rio de Janeiro o relato da doença ocorreu em 1923, e no estado de São Paulo, entre os anos de 1851 e 1853.
Com relação ao DENV-2 e DENV-3, em 1990, ocorreu o início da circulação do DENV-2, e no último mês do ano 2000 o DENV-3 (NOGUEIRA et al., 2005; NOGUEIRA et al., 2008; RODRIGUEZ-BARRAQUER et al., 2011).
3 Chikungunya
O chikungunya (CHIKV ou CKG) RNA vírus do gênero Alphavirus, que em língua makonde significa “aquele que é contorcido”, é caracterizado pela postura de seus pacientes causada pelas fortes dores articulares que apresentam” (TAUIL, 2014). Foi descrito pela primeira vez na região que hoje corresponde à Tanzânia, em 1953 (LUMSDEN, 1955). Um caso foi descoberto nas Américas em 2013, seguido por uma ocorrência no Brasil, onde até outubro de 2014 já se contavam 828 casos (DONALISIO; FREITAS, 2015). Entretanto Honório et al. (2015) discordam de Donalisio e Freitas, afirmando que
Ao longo de 2014 foram confirmados 2.772 casos de CHIKV, distribuídos em seis Unidades Federativas: Amapá (1.554 casos), Bahia (1.214), Distrito Federal (2), Mato Grosso do Sul (1), Roraima (1) e Goiás (1). Em 2015, até a 12ª semana epidemiológica (4 de janeiro a 28 de março de 2015), foram confirmados 1.513 casos autóctones: 735 no Amapá, onde foi identificado o genótipo asiático e 778 casos na Bahia (HONÓRIO et al., 2015, p. 906).
Vasconcelos (2014, 2015) afirma que o provável meio de distribuição ocorreu por transporte aéreo de passageiros, a partir do Quênia. Donalisio e Freitas (2015, p. 284) fizeram uma importante contribuição com relação às características dos sintomas, manifestações neurológicas e comparação entre dengue e Chikungunya:
A Chikungunya se caracteriza por quadros de febre associados à dor articular intensa e debilitante, cefaleia e mialgia. Embora possua sintomas semelhantes ao da dengue, chama a atenção a poliartrite/artralgia simétrica (principalmente punhos, tornozelos e cotovelos), que, em geral, melhora após 10 dias, mas que pode durar meses após o quadro febril. A proporção de casos crônicos variou em diferentes epidemias na França, África Sul e ilhas do oceano Índico, de 4 a 63%. O nome Chikungunya significa “aquele que se curva” na língua Makonde, falada em várias regiões da África Oriental, razão da posição antálgica que os pacientes adquiriam durante o período de doença. Embora quadros severos não sejam comuns e não ocorram choque ou hemorragias importantes como na dengue, manifestações neurológicas (encefalite, meningoencefalite, mielite, síndrome Guillain Barré), cutâneas bolhosas e miocardite podem trazer gravidade aos casos; principalmente, em bebês e idosos. Ao se comparar com a dengue, a Chikungunya apresenta características que amplificam a disseminação da doença e aumentam a possibilidade de grandes e explosivas epidemias. Entre estas características estão a maior proporção de casos sintomáticos (> 90%), menor tempo de incubação intrínseca (de 2 a 7 dias), maior período de viremia (2 antes e 10 depois da febre) e menor período de incubação extrínseca (no mosquito). A replicação viral no mosquito Aedes albopictus além do A. aegypti aumenta a extensão geográfica das regiões com potencial de circulação viral. Existe, ainda, o risco de estabelecimento de um ciclo enzoótico da Chikungunya macaco mosquito no Brasil impossibilitando a erradicação da doença no país.
Assim, tanto o dengue (DENV) quanto o chikungunya (CHIKV) são transmitidos por mosquitos do gênero Aedes, sendo os dois invasores e cosmopolitas. Honório et al. (2015, p. 906) explanam os locais que ambos são encontrados com os respectivos níveis de aglomeração populacional e preferências alimentares:
A primeira, de comportamento antropofílico, é encontrada com maior frequência em locais de aglomeração humana, realizando o repasto sanguíneo e o repouso no interior de habitações. Já a segunda, exibe comportamento alimentar diverso, com maior frequência em áreas de menor aglomeração humana, alimentando-se e repousando preferencialmente no peridomicílio.
Vasconcelos (2014, p. 9) complementa afirmando que a transmissão ocorre “pelo mesmo vetor do dengue, o Aedes aegypti, e, secundariamente, também pelo Aedes albopictus, que espalhou medo, doença, e surpreendentemente, algumas mortes em crianças, idosos e em imunodeprimidos”.
A cautela tem que ser eminente, pois no que tange ao chikungunya a transmissão da mãe para filho é invulgar, entretanto todos os recém-natos infectados durante o momento do parto apresentaram doença sintomática com manifestações graves em 50%, inclusive a encefalopatia em 90% das ocorrências (GERARDIN et al., 2008). A gravidade em recém-natos e o ônus da paralisia cerebral demandam medidas terapêuticas e preventivas, que devem ser antecedidas de confirmação da viremia (período de transmissão da doença aos vetores) materna (HONÓRIO et al., 2015).
4 Vírus Zika
O vírus Zika (ZIKV) é um flavivírus, que surpreendeu o Brasil em 2014, tendo ocorrido uma epidemia em 2015 no Nordeste do país. Os primeiros casos de microcefalia registrados foram em crianças nascidas em janeiro de 2015. Essa patologia possui elevado potencial e o vírus é encontrado ativo na urina e saliva (FIOCRUZ, 2016). A transmissão ocorre pelo mosquito responsável pelo dengue (DENV), o Aedes aegypti.Valle, Pimenta e Aguiar (2016) delinearam três peculiaridades:
[...] total de pessoas afetadas e velocidade de disseminação do vírus; gravidade das manifestações possivelmente associadas ao vírus, incluindo a microcefalia nos filhos de mães acometidas durante a gravidez e o desenvolvimento de sequelas neurológicas em parte das pessoas que adoeceram; e epidemia de (des)informação, disseminada tão - ou mais - rapidamente que a própria situação de Saúde Pública.
Em pesquisas recentes (CARDOSO et al., 2015; DUFFY et al., 2009; MORO, 2010; NUNES et al., 2015; VALLE, PIMENTA; AGUIAR, 2016) foram encontradas muitas contradições com alusão à disseminação do Zika em relação ao chikungunya, identificaram-se três linhas de reflexões para auxiliar na compreensão delineadas por Valle, Pimenta e Aguiar (2016, p.420). A primeira inclui também o período de incubação extrínseco (PIE):
A primeira tentativa de compreensão do fenômeno coloca em xeque as próprias informações enumeradas. Por exemplo: pode ser que o ZIKV tenha entrado no Brasil anteriormente, e permanecido “invisível” ao sistema de saúde, seja porque seus sintomas, quando se manifestam, são brandos, seja porque tenha sido confundido com outras doenças exantemáticas, ou mesmo com a dengue, para a qual o país é hiperendêmico. Quanto aos percentuais conhecidos de sintomáticos - Zika, 20%; chikungunya, 80% -, vale destacar o pequeno tamanho amostral a sustentar essas taxas. Afinal, CKG até 2005 e ZIKV até 2007 eram vírus pouco estudados, restritos à África e regiões da Ásia. Também é ainda pequeno o tamanho amostral usado para a determinação do PIE em Aedes para ZIKV e CKG. Em relação aos vetores, vale mencionar que tanto o ZIKV quanto o CKG são vírus originalmente encontrados em áreas silvestres ou rurais da África, respectivamente, na floresta de Zika (localidade de Uganda que deu nome ao vírus) e na Tanzânia. Nessas regiões, a circulação dava-se, principalmente, entre primatas não humanos e mosquitos silvestres. Eis um ponto de reflexão importante: se não fosse a atividade humana, seja exploratória ou mesmo de vigilância (caso do ZIKV, primeiramente encontrado em macacos rhesus, sentinela para febre amarela), qual seria a probabilidade de esses vírus terem contato com A. aegypti? Hoje, diz-se que A. aegypti e o A. albopictus são os principais transmissores de CKG. No Senegal, entretanto, o mosquito Aedes taylori foi identificado como um elo na transmissão do vírus CKG entre os ambientes silvestre e urbano. Em consonância, é comum ouvir que o A. aegypti é o transmissor do ZIKV. Não obstante, na floresta Zika, a transmissão do ZIKV por Aedes africanus foi confirmada; na epidemia de Yap, na Micronésia, 2007, não havia A. aegypti e sim Aedes hensilli; e na Polinésia Francesa, a transmissão do ZIKV, muito provavelmente, foi carreada por Aedes polynesiensis.
Os autores ainda complementam afirmando que a segunda e terceira linhas de reflexões também são fundamentais visto que podemos observar que
A segunda linha de reflexão relaciona-se a outro “surto”, este deflagrado em paralelo: a epidemia da informação - e da desinformação. Quantas pessoas, de fato, estão infectadas pelo ZIKV? e pelo vírus CKG? Lembre-se que só recentemente o Ministério da Saúde incluiu manifestações decorrentes do ZIKV na Lista Nacional de Notificação Compulsória. Além disso, há significativa sobreposição dos sintomas causados pelo ZIKV com os de DENV, com outras doenças exantemáticas, e mesmo com CKG. Somem-se a isso limitações de diagnóstico específico para Zika. Em resumo, o que se alastrou extremamente rápido? A epidemia do ZIKV ou a quantidade de pessoas que acreditam ter contraído o ZIKV? A terceira argumentação, alvo de considerável polêmica, encontra-se na possibilidade de a transmissão do ZIKV ocorrer por vias alternativas à transmissão vetorial. Trata-se de um fato incomum para o caso dos flavivírus, de forma geral. Porém, há relatos de suspeitas de transmissão sexual do ZIKV desde 2008. A hipótese viu-se reforçada em 2013, quando da detecção de partículas virais ativas no sêmen de um homem no Tahiti. Mais recentemente, surgiram outras evidências nesse sentido: detecção de partículas virais ativas, em quantidade elevada, na urina e na saliva de pacientes com sintomas de fase aguda de infecção pelo ZIKV no Rio de Janeiro. Simultaneamente, novas notícias de potencial transmissão sexual do vírus começam a surgir, como a suspeita de 14 casos entre norte-americanos e de um caso na França. (VALLE; PIMENTA; AGUIAR, 2016, p. 420).
5 Aspectos da Geografia da Saúde
Após 1982, ano que representou o marco para a Geografia da Saúde, os geógrafos que tinham interesse nesta linha de pesquisa da geografia, desenvolveram muitas pesquisas no âmbito da saúde preventiva, visualizando a implantação do Sistema Único de Saúde – SUS, que permitiu a realização de ações da medicina preventiva (VAZ; REMOALDO, 2011). Esse sistema é resultante da universalização dos atendimentos relacionados à saúde prevista na Constituição de 1988, como também na Lei 8.080/90 (FERREIRA, 2015).
A Geografia da Saúde possui duas ênfases de análises: a Nosogeografia e a análise dos serviços de saúde e infraestrutura. Para Peiter (2005) os estudos que tangem a Nosogeografia compreendem a Geografia da Saúde, propondo a identificação dos padrões espaciais das doenças.
Mendonça, Araújo e Fogaça (2014) complementam afirmando que os dois grandes campos de interesse da Geografia da Saúde são: a) Nosogeografia, e b) a abordagem dos Serviços de Saúde. A Nosogeografia é considerada a abordagem mais tradicional, a que se propõe à identificação e análise de padrões de distribuição espacial das questões de saúde e doença como um todo nas relações têmporo-espaciais, tratando diretamente dos determinantes e condicionantes do processo saúde-doença de populações.
A Geografia da Saúde desde seu marco em 1982 até o presente momento (início do século XXI) trabalha os temas da saúde de forma preventiva, ou seja, enfatizando os aspectos da saúde, ao invés da cura. Assim, no âmbito da prevenção, a Geografia da Saúde é utilizada por geógrafos de modo que estes profissionais realizam análise dos fatores sociais e ambientais que podem agravar a saúde, fazendo a correlação dos fatores geográficos com a ocorrência das doenças (SOBRAL, 1988 apud FERREIRA, op. cit.).
Os estudos de Geografia da Saúde possuem papel fundamental no campo dos vetores, principalmente do A. aegypti, que possui relação direta com o espaço geográfico, temperatura, precipitação e a sociedade civil.
6 Procedimentos metodológicos
Os procedimentos foram iniciados por embasamento científico por meio de livros, dissertações, teses, e artigos nas plataformas virtuais:
- 1. Base de Periódicos – Scientific Electronic Library Online – SciELO
- 2. Base de publicações Pubmed
As fontes dos dados foram embasadas no Ministério da Saúde. Monitoramento dos casos de dengue, febre de chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 52, 2016, da Região Sul. Salienta-se ainda que, esse vírus passou a ter notificação compulsória no mês de fevereiro de 2016.
A nomenclatura “casos prováveis” é utilizada para incluir o total absoluto dos casos notificados, com exceção dos que já foram descartados. Os casos autóctones são os casos confirmados que foram detectados no mesmo local onde ocorreu a transmissão. Os casos importados referem-se aos casos importados de outra localidade onde ocorreu a doença. Os casos notificados se referem à comunicação oficial ao órgão de saúde responsável. Os casos confirmados são aqueles suspeitos da doença confirmados em laboratório.
Definida por convenção internacional, as semanas epidemiológicas são contadas de domingo a sábado. A primeira semana do ano é a que contém o número superior de dias de janeiro e a última é a que contém o maior número de dias do mês de dezembro.
Para o cálculo da verificação do coeficiente de incidência foi utilizada a fórmula (Equação 1). O coeficiente de incidência foi calculado utilizando-se o número de casos novos prováveis dividido pela população de determinada área geográfica, expresso por 100 mil habitantes, como indicado por Tronchin et al. (2006).
 (Equação 1)
(Equação 1)7 Resultados e discussão
Os casos prováveis do dengue na Região Sul (Paraná, Santa Catarina e Rio Grande do Sul) apresentaram aumento de 2015 para 2016. Ao realizar o cálculo da taxa de incidência o resultado não foi diferente, havendo aumento para os três estados (Figura 1).
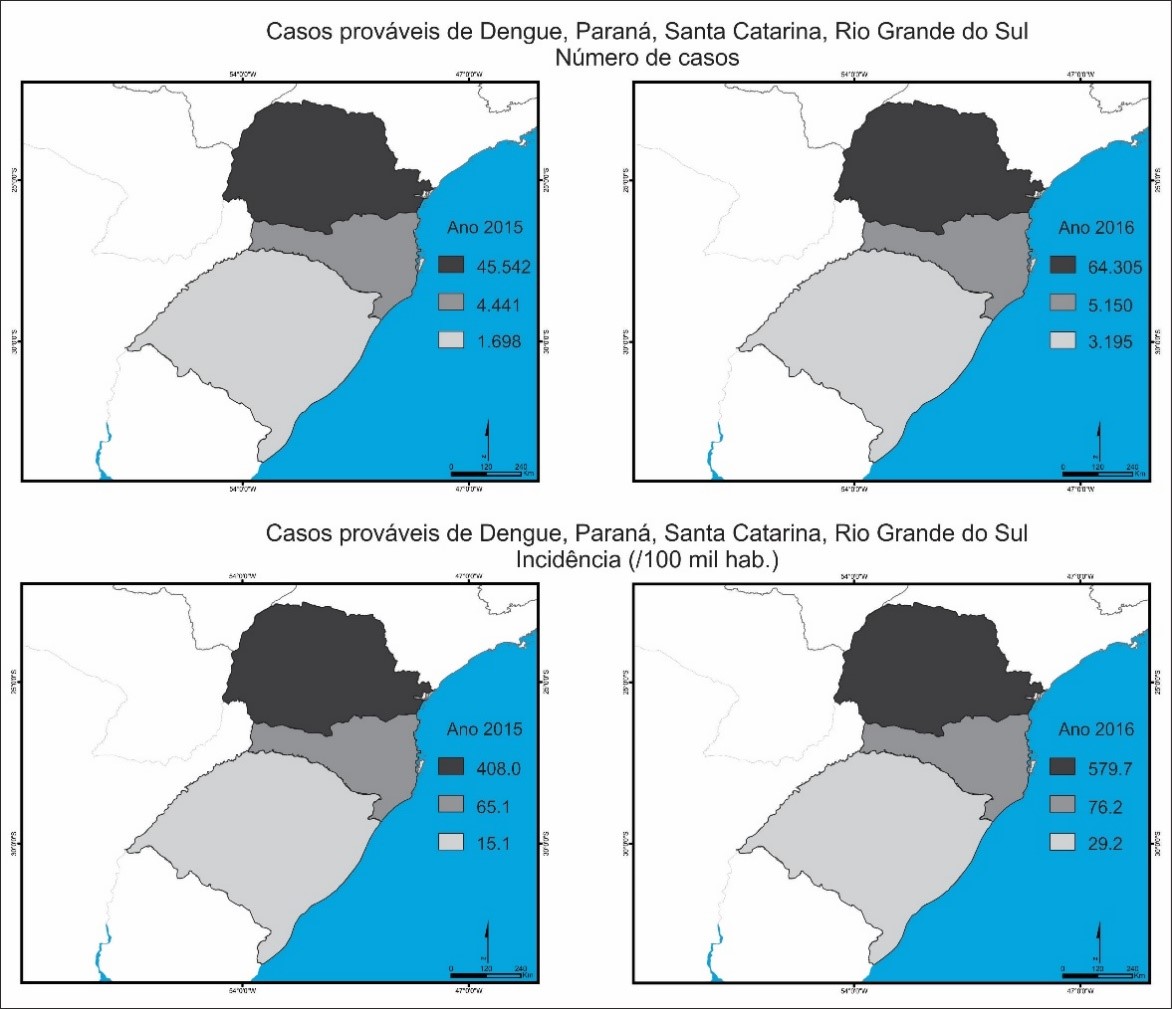
Figura 1.
Número de casos prováveis de dengue e taxa de incidência no Paraná, Santa Catarina e Rio Grande do Sul, 2015 e 2016
Fonte: Brasil (2017)
Comparando os dados dos anos de 2015 e 2016 dos casos prováveis de dengue nos três Estados da Região Sul (Paraná, Santa Catarina e Rio Grande do Sul), foi possível constatar um aumento significativo de casos em cada estado, com destaque para o Estado do Paraná com 45.542 casos em 2015 (408 casos para cada 100 mil habitantes) e 64.305 casos em 2016 (579,7 casos para cada 100 mil habitantes), ou seja, um aumento de 18.763 casos. Santa Catarina teve registrados 4.441 casos em 2015 (65,1 casos para cada 100 mil habitantes) e 5.150 casos em 2016 (76,2 casos para cada 100 mil habitantes), com um acréscimo de 709 casos no intervalo de um ano. Já no Rio Grande do Sul foram registrados 1.698 casos em 2015 (15,1 casos para cada 100 mil habitantes) e 3.195 casos em 2016 (29,2 casos para cada 100 mil habitantes), com um aumento de 1.497 casos no intervalo de um ano.
A grande maioria dos casos de dengue no Paraná em comparação aos demais estados da Região Sul foi devida à propagação do mosquito Aedes aegypti. A explicação se fundamenta principalmente pelas diferenças climáticas. Segundo Paula (2005), que tratou de decifrar a propagação da doença no Paraná relacionando-a às condições climáticas, evidenciou-se a situação vulnerável em que se encontrava no período do estudo (e que ainda se encontra) a população paranaense, tornando o estado um dos que teve o maior aumento proporcional dos casos da doença em todo o país. Tornando mais clara a interferência climática na incidência do dengue, Paula (2005, p. 140) enfatiza essa questão por meio da classificação climática de Köppen, utilizando as classificações: clima temperado úmido (Cfa) com verões, e clima temperado húmido (Cfb) com verões temperados quentes, deixando claro que
A distribuição dos casos autóctones não se dá de forma homogênea, nota-se uma concentração na porção norte-noroeste-oeste do estado, fato este que pode ser atribuído ao tipo climático de domínio sobre esta região: Cfa - quente e úmido. Assim, ao se observar a espacialidade da incidência da dengue no Paraná, fica evidenciada sua estreita relação com as áreas de maior infestação dos mosquitos Aedes albopictus e Aedes aegypti, particularmente deste último. A relação entre a área de maior incidência da doença e a porção mais quente do estado, onde domina o tipo climático Cfa, também apareceram de maneira bastante explícita na abordagem aqui desenvolvida. Os poucos casos autóctones de dengue confirmados em municípios cujo tipo climático é Cfb, é necessário afirmar, ocorreram sob condições térmicas acima da normalidade.
Catão (2011) também afirma em seu trabalho a baixa incidência do dengue na Região Sul do Brasil com relação ao restante do país, mas sempre destacando a diferença entre o número de casos no Paraná comparado com os de Santa Catarina e Rio Grande do Sul somados. O autor explica um número menor de casos na Região Sul devido à temperatura média anual mais baixa. A diferença do Estado do Paraná se explica pela zona de transição climática em que o estado se situa, possuindo áreas com baixa notificação e áreas de maior ocorrência da doença, citando as regiões norte, oeste e noroeste. “As regiões de maior intensidade nesse estado formam um arco entre Foz do Iguaçu e Maringá, que continua por território paulista até o litoral Sul de São Paulo” (CATÃO, 2011, p. 109).
Mendonça (2006b) explica que nos estados de Santa Catarina e Rio Grande do Sul, a grande maioria dos casos do dengue é importada de outras regiões do país, casos estes tendo maior incidência em determinadas áreas, sendo geralmente registrados na porção noroeste dos dois estados, e também no nordeste de Santa Catarina. Todavia, o vetor do dengue é endêmico na região Sul do Brasil, fato que coloca esta vasta área numa condição de elevado risco à incidência de casos autóctones do patógeno num cenário de intensificação do aquecimento climático global-regional.
Segundo Consoli e Oliveira (1994), a espécie em estudo ocorre mais bem próximo da isoterma de 20 °C. Com relação às condições de temperatura para reprodução e evolução do mosquito, as condições impróprias para sua sobrevivência são as temperaturas acima dos 40 °C e abaixo dos 10 ºC (AQUINO JUNIOR, 2014). Assim, os três estados da Região Sul, são favoráveis para haver o desenvolvimento da espécie. De acordo com Mendonça (2003; 2004; 2006a; 2009), a precipitação pluvial tem papel fundamental para reprodução e evolução da espécie, de modo que a água oriunda da precipitação se acumula em diversos locais na área urbana (pneus, latas, vasos, piscinas abandonadas e entre outros), onde o A. aegypti deposita seus ovos, ocorrendo, assim, a reprodução da espécie.
Apesar da amplitude temporal entre o período desta pesquisa e os referenciais citados, a correlação entre a zona climática em que se encontra o estado do Paraná e a maior incidência do dengue em relação aos outros estados da Região Sul também aplica-se à atualidade. De acordo com Aquino Junior (2014), em seu estudo realizado na tríplice fronteira – Paraguai, Brasil e Argentina, um dos principais elementos que fomentam a difusão da doença é o clima, que propicia a formação de criadouros e infestação do vetor. Salienta-se ainda que além dos fatores climáticos, os fatores sociais são os principais para a proliferação do A. aegypti.
Considerando os casos graves do dengue confirmados na Região Sul, o Paraná segue com destaque negativo em relação aos outros estados, tendo um aumento de 107 casos no ano de 2015 para 121 casos em 2016. No estado paranaense, foram 593 casos de dengue com sinais de alarme em 2015 e 527 casos em 2016. Já os demais estados tiveram poucos casos graves confirmados nos dois anos, apesar do aumento. Em Santa Catarina houve um caso grave em 2015 e dois casos em 2016. Com relação aos casos com sinais de alarme foram 112 em 2015 e 62 casos da mesma categoria em 2016, enquanto o Rio Grande do Sul teve dois casos graves registrados em 2015 e sete casos em 2016, com nove casos com sinal de alarme em 2015 e 34 em 2016 (Figura 2).
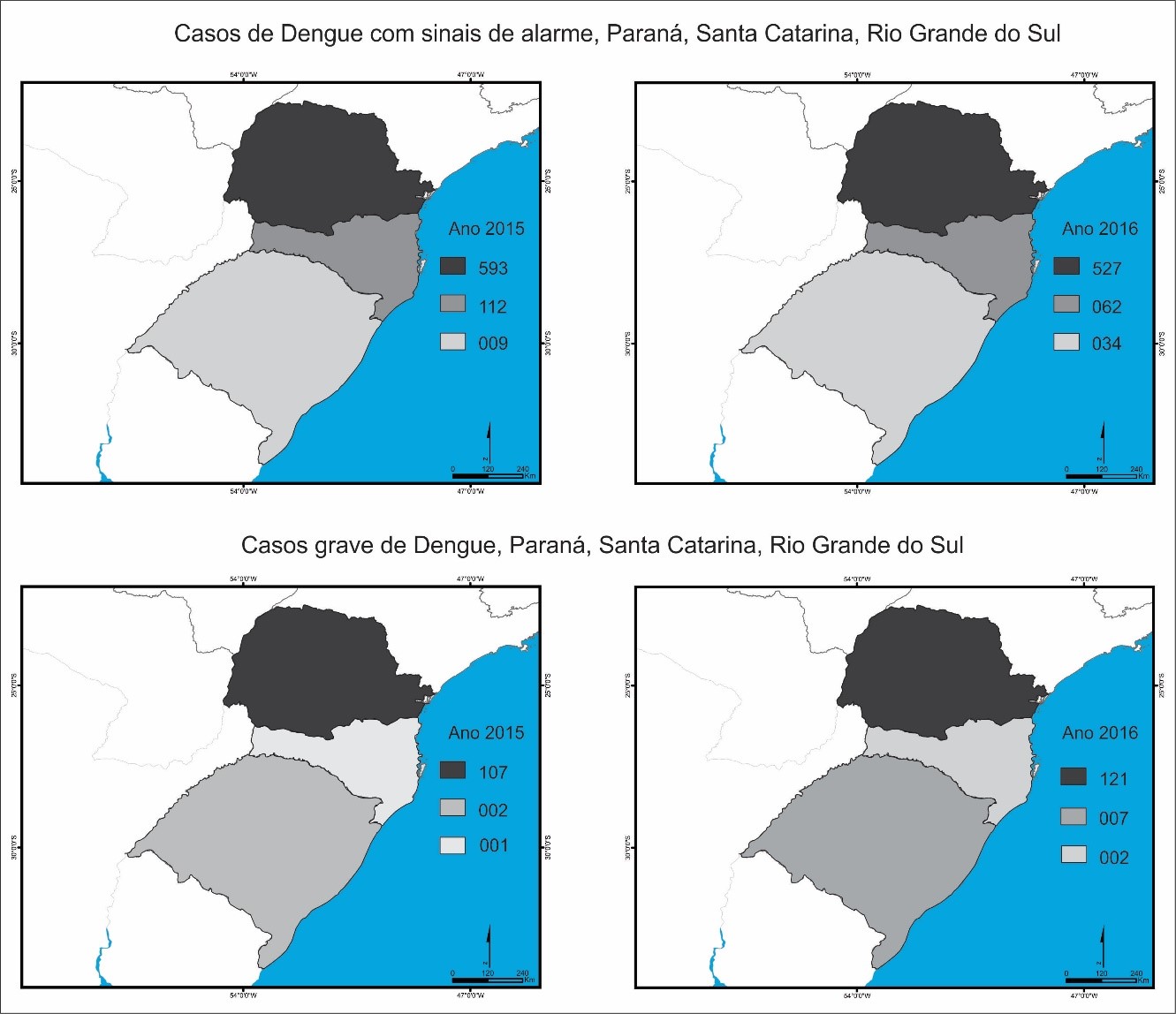
Figura 2.
Número de casos confirmados de dengue grave e de dengue com sinais de alarme no Paraná, Santa Catarina e Rio Grande do Sul em 2015 e 2016
Fonte: Brasil (2017)
O aumento dos casos do dengue e das doenças relacionadas ao vetor (Aedes aegypti) criou a necessidade de se desenvolver ações mais rigorosas para se evitar a rápida disseminação pelo território brasileiro. O Ministério da Saúde definiu maior grau de disseminação do Levantamento Rápido do Índice de Infestação (LIRA) para Aedes aegypti, ferramenta criada para identificar os locais com focos do mosquito nos municípios, que passou a ser obrigatório para todas as cidades com mais de dois mil imóveis. O objetivo é que, com a realização do levantamento, os municípios tenham melhores condições de fazer o planejamento das ações de combate e controle do mosquito Aedes aegypti. Até então, o levantamento era realizado a partir da adesão voluntária de municípios (BRASIL, 2016).
Outro fator enumerado, sendo ele o mais preocupante, foi o número de óbitos causados pelo dengue nos anos de 2015 e 2016 na Região Sul. O estado do Paraná, com maior número, teve confirmados 23 mortes no ano de 2015, sendo que desses, 3,3% foram casos graves somados aos com ou sem sinais de alarme e 64 mortes em 2016, com 9,9% em proporção de óbitos por casos graves somados aos com ou sem sinais de alarme. Já o estado de Santa Catarina não teve nenhum óbito por dengue registrado em 2015, o que não se repetiu em 2016 com duas mortes. Por fim, o Rio Grande do Sul teve 2 óbitos registrados no ano de 2015 e 1 no ano de 2016 (Figura 3).
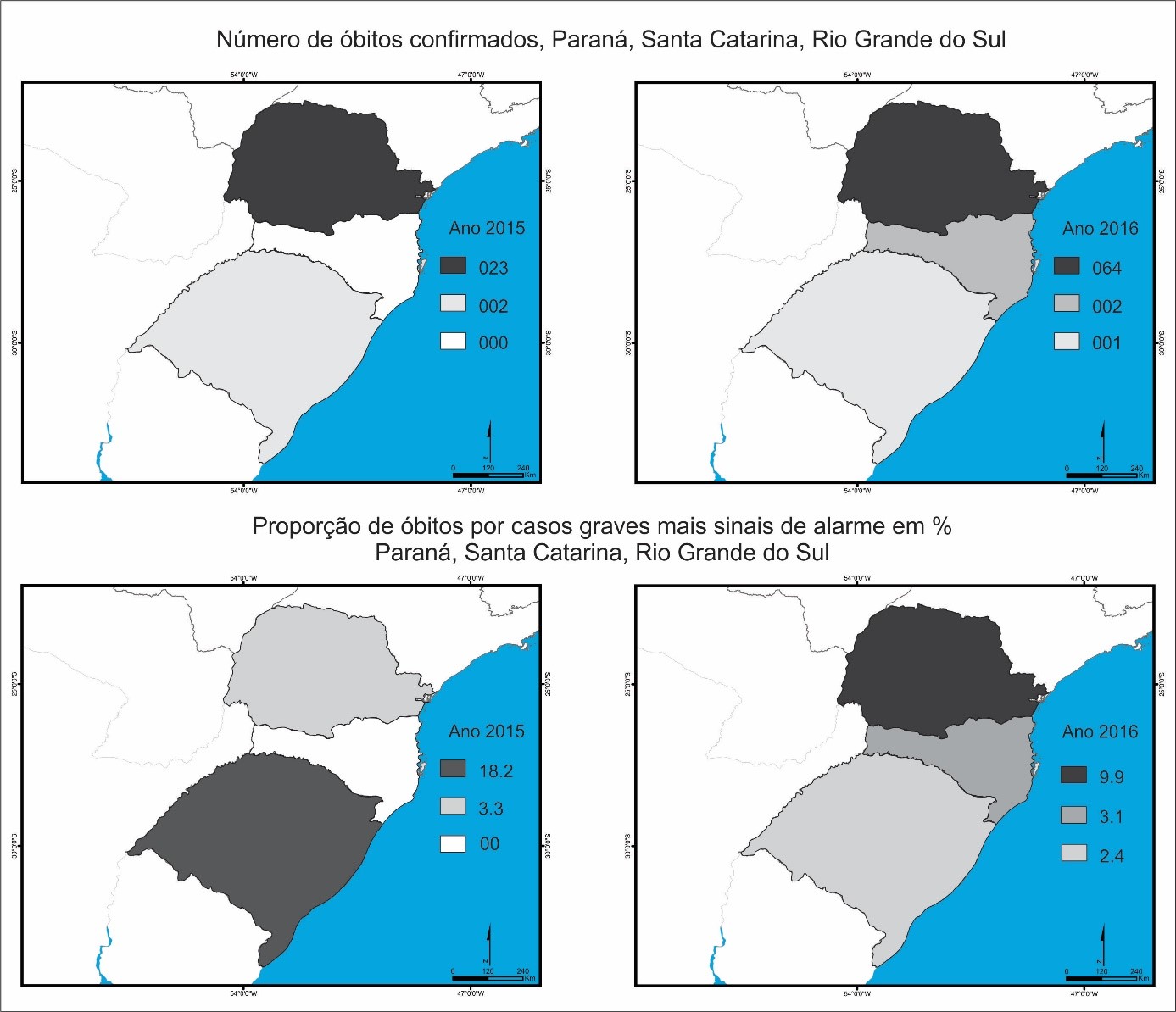
Figura 3.
Número de óbitos confirmados por Dengue e Proporção de óbitos em casos de dengue grave e de dengue com sinais de alarme no Paraná, Santa Catarina e Rio Grande do Sul nos anos de 2015 e 2016
Fonte: Brasil (2017)
Com relação aos prováveis casos de febre chikungunya nos estados da Região Sul, em 2015 o estado do Paraná teve registrados 28 casos (0,2 casos para cada 100 mil habitantes) e em 2016 o registro de 975 casos (8,7 casos para cada 100 mil habitantes). No estado de Santa Catarina foram constatados 17 casos prováveis de chikungunya em 2015 (0,2 casos para cada 100 mil habitantes) e 570 casos no ano de 2016 (8,4 casos para cada 100 mil habitantes). O Rio Grande do Sul teve registrados 19 casos prováveis de chikungunya em 2015 (0,2 casos para cada 100 mil habitantes) e 339 casos em 2016 (3 casos para cada grupo de 100 mil habitantes) (Figura 4).
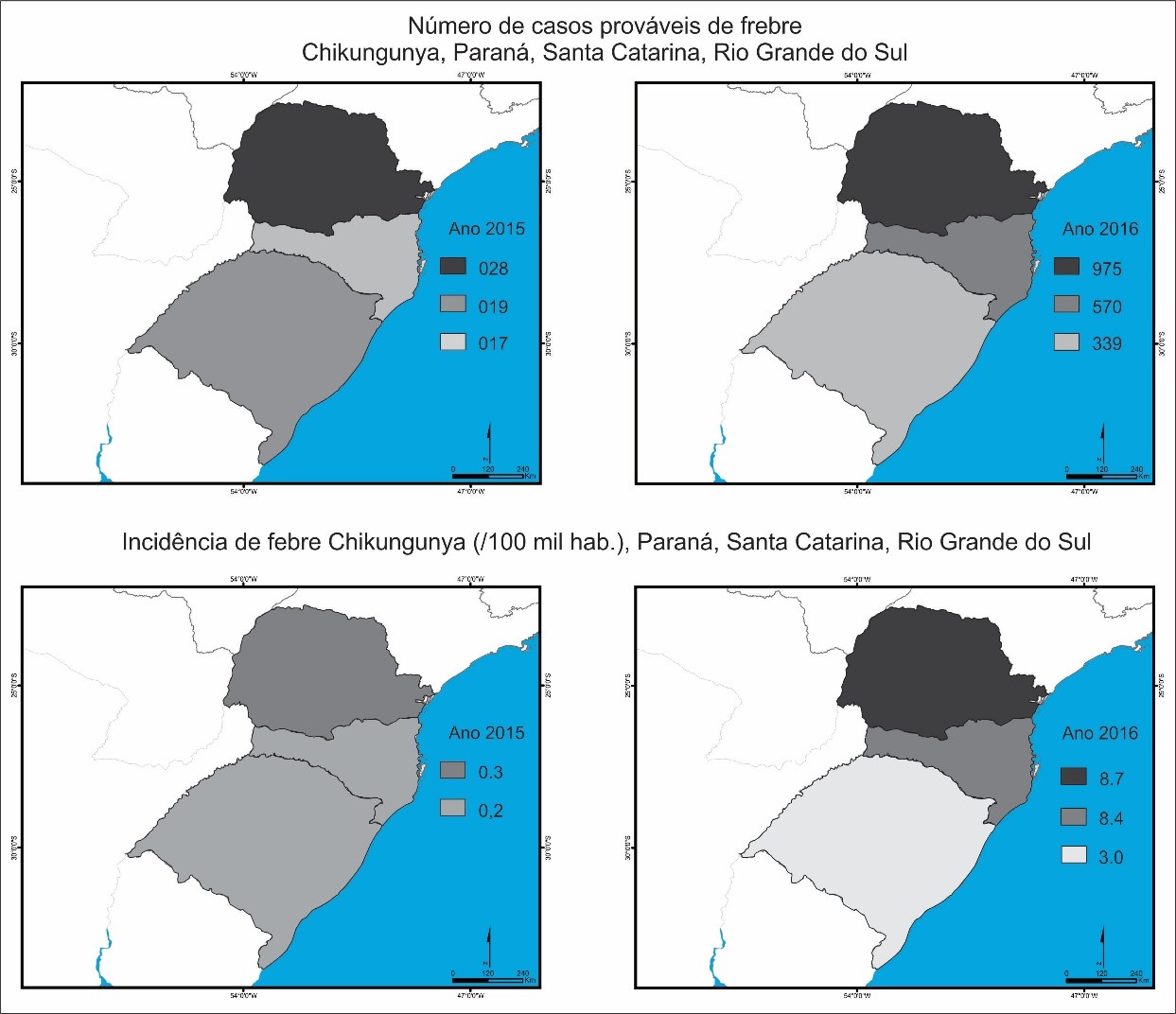
Figura 4.
Número de casos prováveis de febre chikungunya e taxa de incidência no Paraná, Santa Catarina e Rio Grande do Sul em 2015 e 2016
Fonte: Brasil (2017)
O combate ao vetor Aedes aegypti persiste até os dias atuais; uma luta não somente do governo, mas também da sociedade, visto que além de ser o transmissor do dengue também é responsável pela disseminação da chikungunya. Para obter o panorama da situação, Valle, Pimenta e Aguiar (2016, p. 419) salientam:
Foi a experiência acumulada contra a dengue que permeou a preparação do serviço público brasileiro para a entrada no país do vírus chikungunya (CKG), um alphavírus também transmitido pelo A. aegypti. A expansão territorial de CKG desde 2004 suscitou o lançamento de um alerta da Organização Panamericana da Saúde (OPAS), dirigido a todo o continente americano. O Brasil redobrou os esforços de vigilância epidemiológica e chegou a enviar médicos para o Caribe com o objetivo de capacitá-los no reconhecimento dos sinais e sintomas de infecção por CKG. A entrada desse vírus no país era questão de tempo: em setembro de 2014, foi confirmada a transmissão autóctone de CKG entre os brasileiros.
No que diz respeito ao vírus Zika, no ano de 2016 foram registrados 714 prováveis casos no Paraná, com uma proporção de 6,4 casos para cada 100 mil habitantes. Em Santa Catarina foram constatados 92 prováveis casos da doença e o Rio Grande do Sul com 187 casos, todos esses dados referentes ao ano de 2016 (Figura 5).
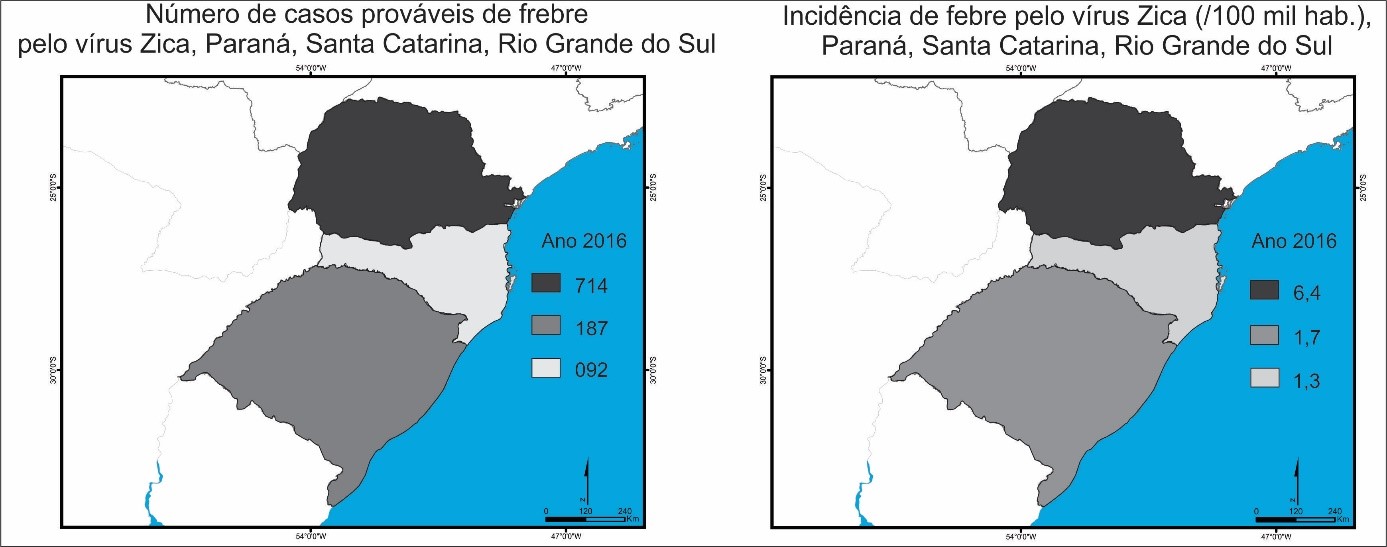
Figura 5.
Número de casos prováveis e taxa de incidência de febre pelo vírus Zika, Paraná, Santa Catarina, Rio Grande do Sul em 2016
Fonte: Brasil, 2017
A indiscutível preocupação com a saúde pública causada pela proliferação dos casos de Zika fez com que o Ministério da Saúde tornasse essencialmente rigorosa a notificação dos casos da doença a partir de fevereiro de 2016 (BRASIL, 2016). Antes do maior risco evidente da recente endemia em território brasileiro, o monitoramento do Zika vírus era realizado por meio de vigilância sentinela. As orientações passadas pelo Ministério da Saúde, no caso do Zika principalmente às gestantes, são as de adoção de medidas para reduzir a presença do mosquito Aedes aegypti, como a eliminação de criadouros, e proteção contra a exposição de mosquitos, mantendo portas e janelas fechadas ou teladas, uso de calça e camisa de manga comprida, além de repelentes recomendados para grávidas (BRASIL, 2016).
Acrescenta-se ainda que, além da importância da conscientização da população para que se evitem os criadouros do Aedes aegypti, a fiscalização deve ser cada vez mais rigorosa, com maior integração dos municípios, dos estados e da união.
8 Conclusão
A partir do presente estudo, foi possível evidenciar as ocorrências bem como o acompanhamento dos aumentos dos casos do dengue, chikungunya e vírus Zika, nos Estado do Paraná, Santa Catarina e Rio Grande do Sul.
O Estado do Paraná foi o que apresentou os maiores valores de dengue, chikungunya e vírus Zika comparado com os outros estados. Os dados relativos correspondentes às taxas sempre se aproximaram aos valores totais da Região Sul. Desta forma, evidencia-se a necessidade por parte do poder público em estabelecer medidas preventivas mais efetivas, que atendam as particularidades de cada região ou Estado.
O governo realiza inúmeras campanhas para evitar a elevação da reprodução do A. aegypti, entretanto essas campanhas normalmente ocorrem com vasta abrangência e divulgação nos meses quentes, somados a chuva, período que é propício aos aumentos dos números de casos. Deve-se então, partir para campanhas que se estendam ao longo do ano, assumindo um caráter para o preventivo e não somente para o corretivo.
No entanto, a luta contra o A. aegypti não cabe somente ao governo, mas também à população, evitando acúmulo de água nos mais diversos locais das residências e às margens das pavimentações. A população deve estar atenta em relação aos resíduos que possam acumular água nas ruas, estradas, quintais, jardins tanto em áreas urbanas quanto nas áreas rurais, para mitigar a reprodução do A. aegypti.
Referências
AQUINO JUNIOR, J. A dengue em área de fronteira internacional: riscos e vulnerabilidades na tríplice fronteira de Foz do Iguaçu. 2014. 203 f. Tese (Doutorado em Geografia) - Universidade Federal do Paraná, 2014.
BASSI, M. G. et al. Resultado da atuação do Centro de Laboratório Regional do Instituto Adolfo Lutz-São José do Rio Preto-X, na implantação do teste rápido e Elisa para dengue NS1. BEPA: Boletim Epidemiológico Paulista (Online), v. 8, n. 89, p. 16-24, 2011.
BOORMAN, J. P. T.; PORTERFIELD, J. S. A simple technique for infection of mosquitoes with viruses transmission of Zika virus. Transactions of the Royal Society of Tropical Medicine and Hygiene, v. 50, n. 3, p. 238-242, 1956.
BRASIL. Notificação nos casos de zika vírus passa a ser obrigatória. Portal Brasil. Brasília, 2016.
BRASIL. Ministério da Saúde. Fundação Nacional de Saúde. Monitoramento dos casos de dengue, febre de chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 52, 2016. Boletim epidemiológico Eletrônico, Brasília, v. 48, n. 3, p. 1-11, 2017.
BRASIL. Ministério da Saúde. Levantamento sobre infestação do mosquito passa a ser obrigatório. Disponível em: http://portalsaude.saude.gov.br/index.php/cidadao/principal/agencia-saude/27475-levantamento-sobre-infestacao-do-mosquito-passa-a-ser-obrigatorio. Acesso em: 10 mar. 2017.
CARDOSO, C. W. et al. Outbreak of exanthematous illness associated with Zika, chikungunya, and dengue viruses. Emerging Infectious Diseases journal, v. 21, n. 12, p. 2274-2276, 2015.
CATÃO, R. C. Dengue no Brasil: abordagem geográfica na escala nacional. 2011. 186 p. Dissertação (Mestrado em Geografia) - Universidade Estadual Paulista, Faculdade de Ciências e Tecnologia, Presidente Prudente, 2011.
CONSOLI, R.; OLIVEIRA, R. L. Principais mosquitos de importância sanitária no Brasil. Rio de Janeiro: Editora FIOCRUZ, 1994. 228 p.
DEGENER, C. M. et al. Evaluation of the effectiveness of mass trapping with BG-sentinel traps for dengue vector control: a cluster randomized controlled trial in Manaus, Brazil. Journal of Medical Entomology, v. 51, n. 2, p. 408-420, 2014.
DONALÍSIO, M. R.; FREITAS, A. R. R. Chikungunya no Brasil: um desafio emergente. Revista Brasileira de Epidemiologia, v. 18, n. 1, p. 283-285, 2015.
DUFFY, M. R. et al. Zika virus outbreak on Yap Island, federated states of Micronesia. New England Journal of Medicine, v. 360, n. 24, p. 2536-2543, 2009.
DUPONT-ROUZEYROL, M. et al. Chikungunya virus and the mosquito vector Aedes aegypti in New Caledonia (South Pacific Region). Vector-Borne and Zoonotic Diseases, v. 12, n. 12, p. 1036-1041, 2012.
FERREIRA, M. E. M. C. Temáticas da geografia brasileira: da medicina geográfica à geografia médica e desta à geografia da saúde. In: ROCHA. M. M.; GARBIN, E. (Org.). Multidisciplinaridade na pesquisa geográfica contemporânea. Maringá: Editora UEM-PGE, 2015. cap. 5, 83-104.
FIOCRUZ. Instituto Oswaldo Cruz. Zika: potencial de infecção em saliva e urina. 2016. Disponível em: http://www.fiocruz.br/ioc/cgi/cgilua.exe/sys/start.htm?infoid=2505&sid=32. Acesso em: 20 nov. 2016.
GERARDIN, D. C. C. et al. Effects of maternal exposure to an aromatase inhibitor on sexual behaviour and neurochemical and endocrine aspects of adult male rat. Reproduction, Fertility and Development, v. 20, n. 5, p. 557-562, 2008.
GUBLER, D. Dengue and Dengue Hemorrhagic Fever. Clinical Microbiology Reviews, Philadelphia, v. 3, n. 11, p. 480–496, 1998.
GUBLER, D. Dengue and dengue hemorrhagic fever: its history and resurgence as a global health problem. In: GUBLER, D.; KUNO, G. (Ed.). Dengue and dengue hemorrhagic fever. New York: CAB International, 1997. p.1-22.
GUBLER, D. The Changing epidemiology of yellow fever and dengue, 1900 to 2003: full circle? Comparative Immunology, Microbiology & Infectious Diseases, v. 27, p. 319–330, 2004.
HONÓRIO, N. A. et al. Chikungunya: an arbovirus infection in the process of establishment and expansion in Brazil. Cadernos de Saúde Pública, v. 31, n. 5, p. 906-908, 2015.
LÖWENBERG NETO, P. Biogeografia de Muscidae (Diptera, insecta) nas regiões andina e neotropical. 2007. 68 f. Dissertação (Mestrado em Biologia) - Programa de Pós-Graduação em Ciências Biológicas (Entomologia), Universidade Federal do Paraná, 2007.
LUMSDEN, W. H. R. An epidemic of virus disease in Southern Province, Tanganyika territory, in 1952–1953 II. General description and epidemiology. Transactions of the Royal Society of Tropical Medicine and Hygiene, v. 49, n. 1, p. 33-57, 1955.
MENDONÇA, F. A. Aquecimento global e saúde: Uma perspectiva geográfica: notas introdutórias. Revista Terra Livre, v. 1, n. 20, p. 205-221, 2003.
MENDONÇA, F. A. Aquecimento Global e suas manifestações regionais e locais: alguns indicadores da região Sul do Brasil. Revista Brasileira de Climatologia, v. 2, p. 71- 86, 2006a.
MENDONÇA, F. A. Clima, tropicalidade e saúde: Uma perspectiva a partir da intensificação do aquecimento global. Revista Brasileira de Climatologia, v. 1, n. 1, 2006b.
MENDONÇA, F. A. Dengue: Dinâmica Espacial e Condicionantes Climáticos na Região Sul do Brasil. In: CONFALONIERI, U.E.C.; MENDOZA, M.; REYES, L.F. (Ed.). Efectos de los cambios globales sobre La salud humana y La seguridad alimentaria. Buenos Aires, Argentina: Programa Iberoamericano de Ciencia y Tecnología para El Desarrollo, 2009. p. 22-31.
MENDONÇA, F. A. Rechauffement global et santé: Aspects généraux et quelques particularités du Monde Tropical. Annales de l’Association Internationale de Climatologie, v. 1, p. 157-175, 2004.
MENDONÇA, F.; ARAUJO, W. M.; FOGAÇA, T. K. A geografia da saúde no Brasil: Estado da arte e alguns desafios. Investigaciones Geográficas, n. 48, p. 41-52, 2014.
MORO, M. L. et al. Chikungunya virus in North-Eastern Italy: a seroprevalence survey. The American journal of tropical medicine and hygiene, v. 82, n. 3, p. 508-511, 2010.
NOGUEIRA, M. B. et al. Evidence for the co-circulation of dengue virus type 3 genotypes III and V in the Northern region of Brazil during the 2002-2004 epidemics. Memórias do Instituto Oswaldo Cruz, v. 103, n. 5, p. 483-488, 2008.
NOGUEIRA, R. et al. Dengue virus type 3, Brazil, 2002. Emerging Infectious Disease journal, v. 11, n. 9, 2005.
NORMILE, D. Surprising new dengue virus throws a spanner in disease control efforts. Science, v. 342, n. 6157, p. 415, 2013.
NUNES, M. R.T. et al. Emergence and potential for spread of Chikungunya virus in Brazil. BMC medicine, v. 13, n. 1, p. 1-10, 2015.
OMS. Organização Mundial de Saúde. Prevention and control of Dengue and Dengue Haemorraghic Fever: comprehensive guidelines. Nova Deli: Regional office for South-East Asia World Health Organization, 1999.
OSANAI, C. H. et al. Dengue outbreak in Boa Vista, Roraima. Preliminary report. Revista do Instituto de Medicina Tropical de São Paulo, v. 25, n. 1, p. 53-54, 1983.
PAULA, E. V. Evolução espaço-temporal da dengue e variação termo-pluviométrica no Paraná: uma abordagem geográfica. Revista RA´E GA, Curitiba, n. 10, p. 33-48, 2005.
PEITER, P. C. A Geografia da Saúde na Faixa de Fronteira Continental do Brasil na Passagem do Milênio. 2005. 314p. Tese (Doutorado em Geografia) - Universidade Federal do Rio de Janeiro, 2005.
RANGA, S. et al. Dengue haemorrhagic fever: an overview. Indian journal of pathology & microbiology, v. 40, n. 1, p. 103-17, 1997.
RODRIGUEZ-BARRAQUER, I. et al. From re-emergence to hyperendemicity: the natural history of the dengue epidemic in Brazil. PLoS neglected tropical diseases, v. 5, n. 1, p. e935, 2011.
SCHATZMAYR, H. G; NOGUEIRA R. M; TRAVASSOS DA ROSA, A. P. An outbreak of dengue virus at Rio de Janeiro-1986. Mem Inst Oswaldo Cruz, v. 81, n. 2, p. 245-246, 1986.
SIMONE, L. R. L. Land and Freshwater Molluscs of Brazil. São Paulo: Museu de Zoologia. Universidade de São Paulo, 2006. 390 p.
TAUIL, P. L. Condições para a transmissão da febre do vírus chikungunya. Epidemiologia e Serviços de Saúde, Brasília, v. 23, n. 4, p. 773-774, 2014. Disponível em: http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S167949742014000400020&lng=pt&nrm=iso. Acesso em: 10 fev. 2017.
TAUIL, P. L. Urbanização e ecologia do dengue. Cadernos de Saúde Pública, Rio de Janeiro, v. 17, supl. n. l, p. 99-102, 2001.
TRONCHIN, D. M. R.; MELLEIRO, M. M.; MOTA, N. V. y V. P. Indicadores de qualidade de enfermagem: uma experiência compartilhada entre instituições integrantes do Programa de Qualidade Hospitalar. O Mundo da saúde, v. 30, n. 2, p. 300-305, 2006.
VALLE, D.; PIMENTA, D. N.; AGUIAR, R. Zika, dengue e chikungunya: desafios e questões. Epidemiologia e Serviços de Saúde, Brasília, v. 25, n. 2, p. 419-422, jun. 2016. Disponível em: http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S167949742016000200419&lng=pt&nrm=iso. Acesso em: 01 fev. 2017.
VASCONCELOS, P. F. C. Doença pelo vírus Zika: um novo problema emergente nas Américas? Revista Pan-Amazônica de Saúde, Ananindeua, v. 6, n. 2, p. 9-10, jun. 2015. Disponível em: http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S217662232015000200001&lng=pt&nrm=iso. Acesso em: 06 jan. 2017.
VASCONCELOS, P. F. C. Emergência do vírus Chikungunya: risco de introdução no Brasil. Revista Pan-Amazônica de Saúde, Ananindeua, v. 5, n. 3, p. 9-10, set. 2014. Disponível em http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S217662232014000300001&lng=pt&nrm=iso. Acesso em: 05 fev. 2017.
VAZ, D. dos S.; REMOALDO, P. C. A. A Geografia da Saúde brasileira e portuguesa: algumas considerações conceptuais. GEOUSP: Espaço e Tempo, São Paulo, n. 29, p. 173-192, 2011.
VEGA-RÚA, A. et al. High level of vector competence of Aedes aegypti and Aedes albopictus from ten American countries as a crucial factor in the spread of Chikungunya virus. Journal of virology, v. 88, n. 11, p. 6294-6306, 2014.
WHO. World Health Organization. Dengue haemorrhagic fever: diagnosis, treatment, prevention and control. Geneva, 1997.
WHO. World Health Organization. Dengue: guidelines for diagnosis, treatment, prevention, and control. Special Programme for Research and Training in Tropical Diseases, p. 147, 2009.
Notas
Notas de autor