ARTIGOS ORIGINAIS
Análise do consumo de cloro para oxidação da espécie de cianobactéria Microcystis aeruginosa
Analysis of the chlorine consumption for oxidation of the cyanobacteria species Microcystis aeruginosa
Análisis del consumo de cloro para la oxidación de la especie de cianobacteria Microcystis aeruginosa
Análise do consumo de cloro para oxidação da espécie de cianobactéria Microcystis aeruginosa
Vértices (Campos dos Goitacazes), vol. 20, núm. 2, 2018
Instituto Federal de Educação, Ciência e Tecnologia Fluminense

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 16 Mayo 2018
Aprobación: 07 Agosto 2018
Resumo: Este estudo avaliou o consumo de cloro da espécie Microcystis aeruginosa presente nas florações em mananciais de abastecimento, pois a legislação exige a manutenção mínima de 0,2 mg.L-1 de cloro residual livre ou 2 mg.L-1 de cloro residual combinado e um residual de 3 a 5 mg.L-1 após 7 dias. Em escala de laboratório realizaram-se análises com cloro gasoso: 8 doses para ensaios de 30 minutos e 24 horas; e outras 7 para ensaios de 7 dias. Os resultados, em média, demonstraram alto consumo de cloro, podendo ter relação com a formação de subprodutos da cloração no tratamento de água.
Palavras-chave: Consumo de cloro, Microcystis aeruginosa, Cloro gasoso, Método colorimétrico.
Abstract: This study evaluated the chlorine consumption of the Microcystis aeruginosa species present in blooms in water supply sources, since the legislation requires the minimum maintenance of free residual chlorine should be 0.2 mg.L-1 or 2 mg.L-1 of combined residual chlorine and a residue from 3 to 5 mg.L-1 after 7 days. Chlorine gas analyzes were performed in laboratory scale: 8 dosages for 30 minutes and 24 hours tests and 7 dosages for 7 days. The results showed high chlorine consumption, what can be related to by-products formation of chlorination in the water treatment.
Keywords: Chlorine consumption, Microcystis aeruginosa, Chlorine gas, Colorimetric method.
Resumen: Este estudio evaluó el consumo de cloro de la especie Microcystis aeruginosa presente en las floraciones en manantiales de abastecimiento, pues la legislación exige el mantenimiento mínimo de 0,2 mg.L-1 de cloro residual libre o 2 mg.L-1 de cloro residual combinado y un residuo de 3 a 5 mg.L-1 después de 7 días. En escala de laboratorio se realizaron análisis con cloro gaseoso: 8 dosis para ensayos de 30 minutos y 24 horas; y otras 7 para ensayos de 7 días. Los resultados, en promedio, demostraron alto consumo de cloro, pudiendo tener relación con la formación de subproductos de la cloración en el tratamiento de agua.
Palabras clave: Consumo de cloro, Microcystis aeruginosa, Cloro gaseoso, Método colorimétrico.
1 Introdução
As cianobactérias são micro-organismos procariontes, uni ou pluricelulares, aeróbios e fotoautotróficos, antes consideradas como algas azuis ou cianofíceas. São pertencentes à classe Cyanophyceace, e segundo Komárek et al. (2014), divididas em oito ordens: Gloeobacterales; Synechococcales; Spirulinales; Chroococcales; Pleurocapsales; Oscillatoriales; Chroococcidiopsidales e Nostocales. São consideradas de grande importância para o ciclo do nitrogênio e possuem estruturas semelhantes às bactérias, podendo ser filamentosas, unicelulares e coloniais. Em relação às funções metabólicas, assim como as algas, as cianobactérias também realizam fotossíntese (FUNASA, 2007; ACERO; RODRIGUEZ; MERILUOTO, 2005; ZAMYADI et al., 2012a).
O despejo de poluentes, provenientes do aumento da produção de efluentes agrícolas, domésticos e industriais, com alto teor de matéria orgânica e nutrientes nos corpos hídricos, ocasionam a eutrofização dos mesmos (MACEDO; SIPAÚBA-TAVARES, 2010). Além disso, tem sido uma das causas da abundante proliferação de algas e cianobactérias potencialmente tóxicas em reservatórios e corpos d’água usados para abastecimento público (MIRANDA, 2014). Conhecido na literatura também como floração ou bloom, a eutrofização tem sido cada vez mais frequente e é pertinente visto que ocasiona alterações nas características físico-químicas e na cadeia trófica dos ecossistemas aquáticos (MA et al., 2012; ZAMYADI et al., 2012a; FUNASA, 2015).
As florações podem promover a liberação de substâncias que ocasionam, por exemplo, odor e gosto à água. Entretanto, a principal preocupação se deve à capacidade de algumas espécies de cianobactérias de produzirem compostos tóxicos, conhecidos como cianotoxinas (CAMACHO et al., 2012; BORTOLI; PINTO, 2015). Como apresentam potencial tóxico característico das cianobactérias e, portanto, possíveis riscos à saúde pública, é imprescindível um rigoroso monitoramento desse fenômeno (ZAMYADI et al., 2012a; FUNASA, 2015).
A espécie Microcystis aeruginosa (Kützing) Kützing é formada por colônias micro ou macroscópicas, arredondadas quando jovens, e tornam-se alongadas, irregulares ou lobadas quando adultas; e às vezes clatradas. Ainda possuem mucilagem hialina, difluente, formando uma ampla margem em volta das colônias; e as células são esféricas, com diâmetro de 4 a 6,5 μm, com aerótopos e possuem conteúdo celular verde-escuro (SANT’ANNA et al., 2004). Devido à grande variabilidade morfológica apresentada pelas suas morfoespécies, a taxonomia do gênero Microcystis, o qual é caracterizado por apresentar colônias com aglomerados irregulares de células esféricas, não estratificadas e com mucilagem incolor, é problemática (KOMÁREK; KOMÁRKOVÁ, 2002). De acordo com Freitas (2012), a forma e o tamanho das colônias, a estrutura da mucilagem, o tamanho e arranjo das células nas colônias são características fundamentais para a identificação das espécies. Há relatos de incidência da espécie em águas superficiais, com distribuição ampla no Brasil, ocorrendo de norte a sul do país (SANT’ANNA et al., 2008; ARAGÃO, 2011).
A proliferação da espécie Microcystis aeruginosa forma um tapete microbiano que pode cobrir a superfície da água, reduzindo a incidência de luz solar, e, portanto, a atividade fotossintética do ecossistema. Desse modo, as concentrações de oxigênio dissolvido tendem a reduzir gerando micro-habitats anaeróbios no corpo d´água e degradação do ecossistema local. A referida espécie é capaz de produzir uma potente cianotoxina, a microcistina, danosa principalmente ao fígado e potencialmente prejudicial ao ser humano (LEAL; SOARES, 2004). A ingestão de água ou de células de cianobactérias contendo microcistina tem produzido efeitos adversos em peixes, cães, gatos, animais e seres humanos (SANT’ANNA et al., 2008).
CETESB (2013) menciona os níveis de monitoramento conforme o número de células de cianobactérias, conforme Tabela 1.
| Nível monitoramento | Células de cianobactérias (células.mL-1) |
| Baixa – Nível 1 | 20.000 (2,0 x 104) |
| Moderada – Nível 2 | 100.000 (1,0 x 105) |
| Alta – Nível 3 | 1.000.000 (1,0 x 106) |
Os limites considerados para um alerta de nível 2 (concentração de células de cianobactérias igual ou superior a 1,0 x 105 células.mL-1, com presença de cianotoxinas confirmada por análises químicas ou bioensaios), são condições que retratam um risco significativo de efeitos adversos à saúde humana pelo abastecimento de água não tratada.
Os oxidantes químicos são frequentemente utilizados para inativação de micro-organismos no tratamento de água, como, por exemplo, o cloro gasoso, hipoclorito de sódio, hipoclorito de cálcio, ácido peracético, permanganato de potássio, peróxido de hidrogênio, dióxido de cloro, ozônio, cloraminas e radiação ultravioleta (PROSAB, 2001). De acordo com Mondardo, Sens e Melo Filho (2006) e Libânio (2010), os compostos penetram através da membrana celular dos micro-organismos e atacam os constituintes celulares de importância vital, alterando a estrutura e organização das células, além de promover a inativação de enzimas importantes para o metabolismo dos micro-organismos, interferindo na biossíntese de macromoléculas, como ácidos nucléicos e proteínas, impossibilitando a sobrevivência dos mesmos.
Nesse sentido, por atender de forma eficiente a todos os critérios citados anteriormente, o cloro, sob diversas formas, tornou-se o oxidante mais difundido no tratamento de água. Essa preponderância de certa forma tem favorecido a identificação do processo como cloração que, segundo Libânio (2010), Di Bernardo e Paz (2008), tornou-se essencial no tratamento de água, tendo como objetivo inativar ou eliminar micro-organismos patogênicos, causadores de graves enfermidades ao homem, seja ao longo das tubulações da rede de distribuição ou mesmo nos reservatórios domiciliares dos pontos de consumo. Alcançam-se, desta maneira, condições dentro da legislação, além de remover, por exemplo, a matéria orgânica dissolvida causadora de cor, odor e gosto na água. Ainda, estudos relatam a eficiência do cloro na oxidação de cianotoxinas liberadas, devido à lise celular, pela Microcystis aeruginosa e por demais espécies de cianobactérias (ZAMYADI et al., 2012b; CHENG et al., 2009; NICHOLSON; ROSITANO; BURCH, 1994). Zamyadi et al. (2012b), por exemplo, relatam oxidação de microcistina MC-LR de 73% e 91% usando doses de cloro de 2 e 5 mg.L-1, respectivamente.
Segundo Art. 34 do anexo XX da Portaria de Consolidação MS 5 de 28 de setembro de 2017, a manutenção de, no mínimo, 0,2 mg.L-1 de cloro residual livre (CRL), ou 2 mg.L-1 de cloro residual combinado (CRC), ou de 0,2 mg.L-1 de dióxido de cloro, é obrigatória em toda a extensão do sistema de distribuição (reservatório e rede). De acordo com o art. 39 § 2º, é recomendado que em qualquer ponto do sistema de abastecimento o teor máximo de cloro residual livre seja de 2 mg.L-1. Uma medida frequentemente usada para avaliar a formação de substâncias orgânicas halogenadas (SOHs) é conhecida como potencial de formação, relacionado com a medida indireta da quantidade do material precursor total que está na água em um dado ponto do sistema em estudo, como manancial ou mesmo uma estação de tratamento. Portanto, se a água apresenta um alto potencial é porque ela apresenta características propícias para a formação de SOHs. No Standard Methods for the Examination of Water and Wastewater existem ensaios que auxiliam em pesquisas qualitativas e quantitativas em relação às SOHs. O potencial de formação sob condições preestabelecidas (pH 7,0; 25 °C; 7 dias de incubação com 3-5 mg.L-1 de CRL) é normalmente utilizado para comparar o potencial de formação de SOHs entre mananciais ou sistemas de tratamento diferentes entre países do hemisfério norte (APHA, 2012).
Desse modo, torna-se relevante o estudo do consumo de cloro da espécie Microcystis aeruginosa para determinar quais dosagens que apresentam conformidade às exigências da Portaria de Consolidação MS 5/2017 e APHA (2012).
2 Metodologia
2.1 Manutenção, cultivo e contagens de células
Células de Microcystis aeruginosa foram obtidas pelo laboratório de Ficologia, ICB-UFMG, em densidades distintas, e cultivadas no Laboratório Multiusuário e no de Contaminantes do Instituto de Ciência, Engenharia e Tecnologia (ICET), localizados na Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM) campus Mucuri, em Teófilo Otoni/MG. Conforme orientação de Jacinavicius et al. (2013), manteve-se a cultura específica de Microcystis aeruginosa sob as seguintes condições: temperatura 24 ± 2.C, irradiância 40-50 µmol fótons m-2.s-1 e fotoperíodo 14-10 horas claro-escuro, conduzidas em erlenmeyers replicados de 500 mL e 1 L para evitar qualquer tipo de contaminação externa. O meio para o cultivo foi o ASM-1 e as densidades usadas foram 1,0 x 104 células.mL-1 (concentração recorrente após a etapa de clarificação em ETAs) e 1,0 x 106 células.mL-1 (usuais em mananciais de abastecimento eutrofizados). Foi necessário ajustar o pH da solução a 7,4; adicionando HCl (ácido clorídrico) 1M para acidificar o meio e NaOH (hidróxido de sódio) 1M para elevar o pH. O meio de cultura concentrado foi armazenado no freezer até ser diluído para uso.
Para repiques das culturas de Microcystis aeruginosa, operou-se dentro de uma câmera de fluxo laminar, a qual foi submetida à ação de luz ultravioleta (UV) por aproximadamente 15 minutos para evitar possíveis contaminações de outros micro-organismos. Após esse tempo, a superfície da câmera era limpa com álcool 70%. Retirou-se, com o auxílio da pipeta, 10 µL da amostra homogeneizada a ser analisada e as células foram deixadas por aproximadamente 2 minutos para sedimentação antes de iniciar a contagem por meio da câmera de Neubauer. Sempre quando atingido a densidade de aproximadamente 1,0 x 106 células.mL-1, repiques foram efetuados obedecendo a diluição de 1:10 para a renovação das culturas e para a obtenção de 1,0 x 104 células.mL-1, 1:100.
2.2 Ensaios de consumo de cloro
O cloro gasoso, escolhido como oxidante, foi obtido na unidade da COPASA, região do Alto Mucuri, em Teófilo Otoni/MG. A concentração real da solução de cloro gasoso foi determinada por iodometria (titulação com tiossulfato de sódio, amido e iodeto de potássio). O mesmo foi utilizado imediatamente após a titulação para não haver perdas no processo. Após a determinação da concentração real (C1) de cloro, realizaram-se os cálculos para a concentração de cada dose (C2), obedecendo a Equação 1:
Uma vez que as concentrações de cloro utilizadas nas ETAs são escolhidas através da concentração de CRL que deverá estar presente na água após o tratamento, as concentrações mais recorrentes variam de 2,5 a 5,0 mg.L-1. Para obter uma maior variabilidade estatística dos dados obtidos para a etapa, ensaios (n=7) com volumes de 50 mL foram utilizados nas concentrações 1,0; 1,5; 2,0; 2,5; 3,75; 5,0; 7,5; 10,0 mg.L-1.
O teor de CRL após o término do tempo de contato de 30 minutos (avaliação nos primeiros minutos de formação) e 24 horas (referente à formação ao longo da rede de distribuição) foi observado para que, segundo a referida portaria, a concentração mínima fosse 0,2 mg.L-1 de CRL. As leituras de concentração de CRL foram efetuadas por método colorimétrico com adição de N-dietil-para-fenilendiamina (DPD), através de um comparador colorimétrico (HACH). A Figura 1 representa o fluxograma descritivo do ensaio para a cloração da espécie Microcystis aeruginosa.
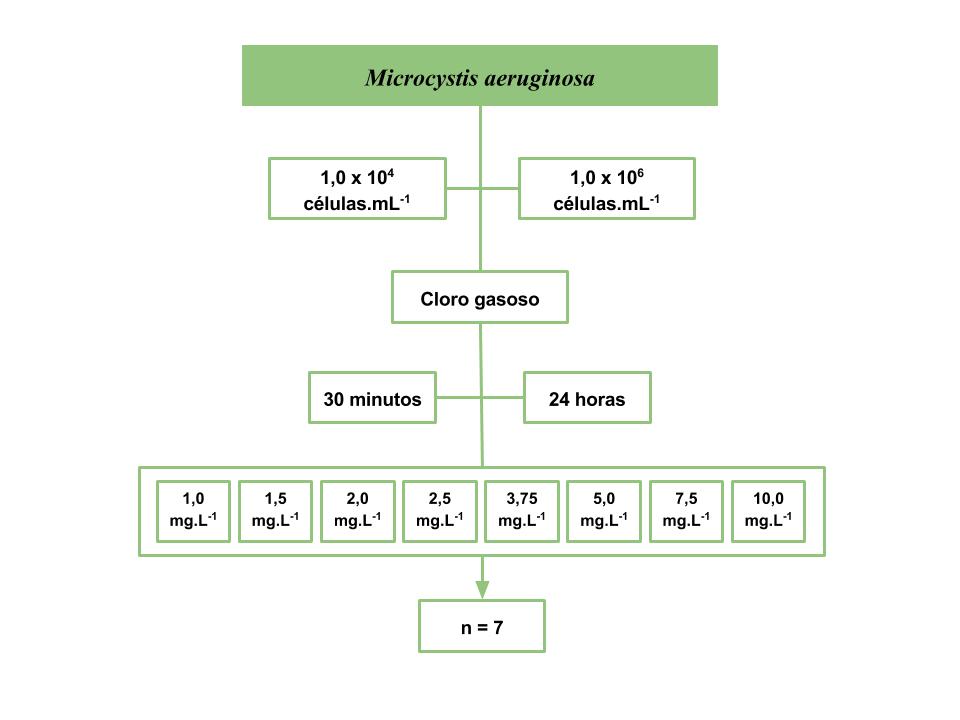
Figura 1.
Fluxograma do ensaio para cloração da espécie com 30 minutos e 24 horas de contato
Além desses, realizaram-se ensaios com a espécie para determinar a concentração de oxidante capaz de gerar um CRL entre 3,0 e 5,0 mg.L-1 ao fim dos 7 dias de contato, conforme estabelecido no método 5710B, do Standard Methods (APHA, 2012). Para as densidades já definidas da espécie, submeteram-se amostras (50 mL) a 7 diferentes doses elevadas de cloro gasoso (10,0; 12,5; 15,0; 17,5; 20,0; 25,0 e 30,0 mg.L-1) de forma a obter o residual esperado. Após a cloração, os frascos foram lacrados e armazenados em uma caixa fechada para evitar o contato com a luz e, após os 7 dias, mediu-se o CRL pelo método colorimétrico. A Figura 2 apresenta o fluxograma das etapas do potencial de formação de 7 dias para a Microcystis aeruginosa.
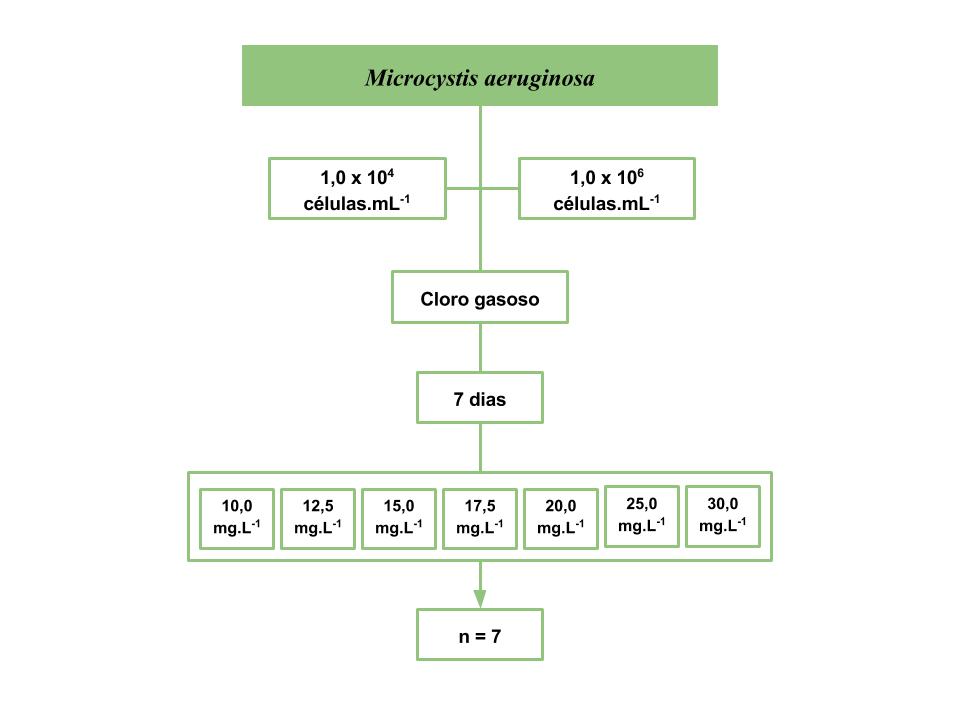
Figura 2.
Fluxograma do ensaio para cloração da espécie com 7 dias de contato
3 Resultados e discussões
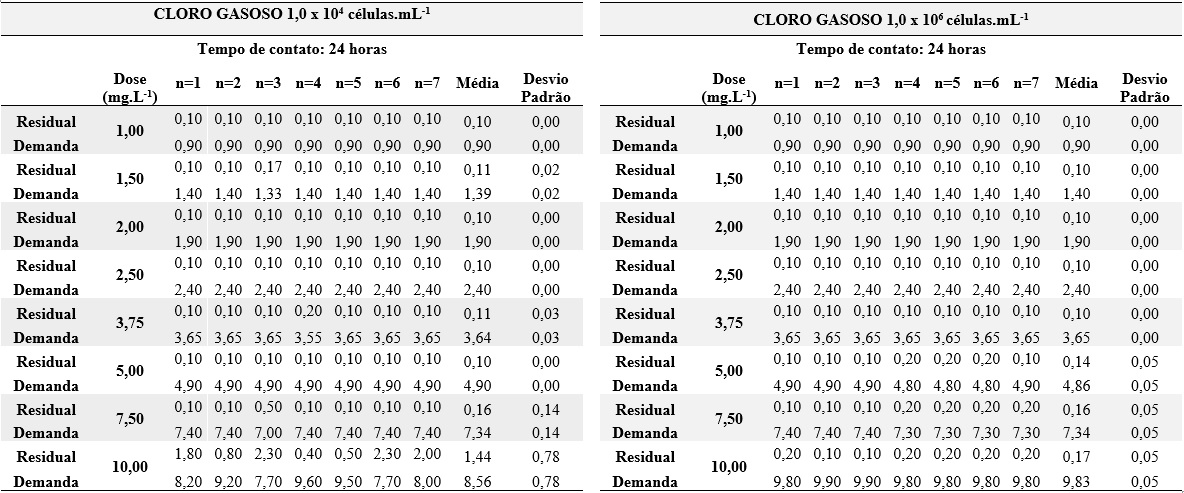
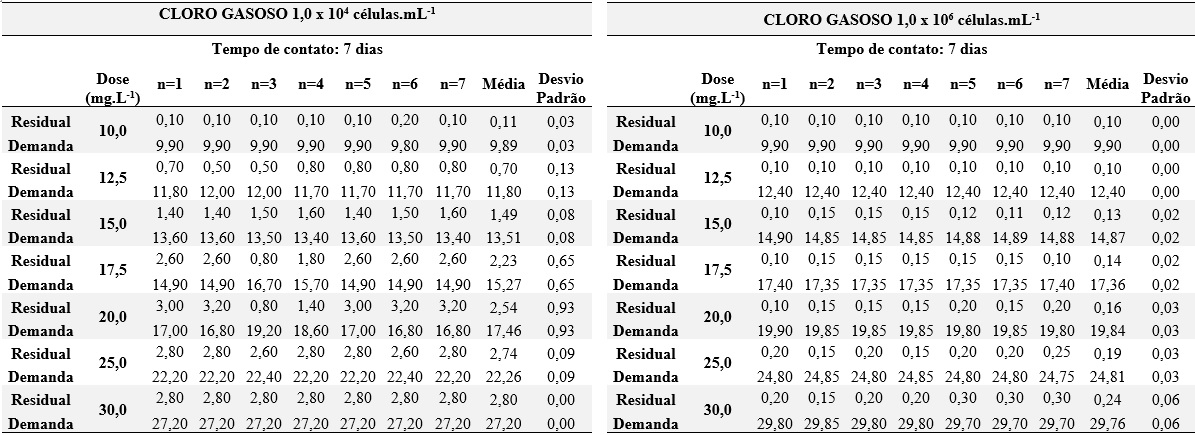
As Tabelas 2, 3 e 4 apresentam os resultados do consumo de cloro sob as condições estabelecidas nas concentrações 1,0 x 104 células.mL-1 e 1,0 x 106 células.mL-1.
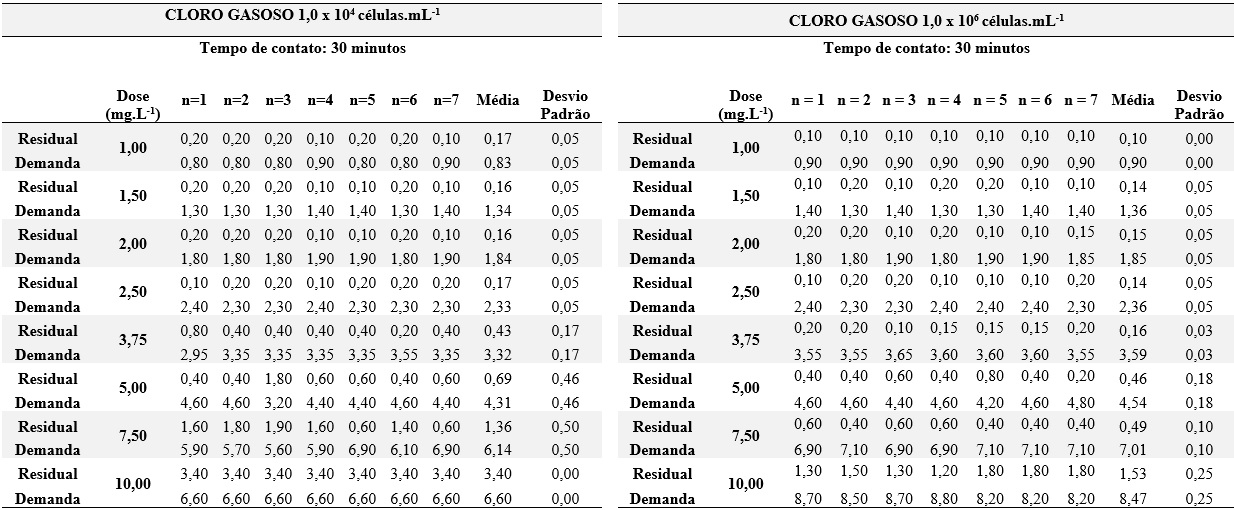
As concentrações de cloro residual obtidas para o tempo de contato de 30 minutos, conforme Tabela 2, apresentaram valores acima de 0,2 mg.L-1 e abaixo de 2 mg.L-1, como exigido pela Portaria de Consolidação MS 5/2017, para todos os ensaios nas doses 3,75 a 7,5 mg.L-1 para densidade 1,0 x 104 células.mL-1 e a partir da dose 5 mg.L-1 para 1,0 x 106 células.mL-1. De acordo com Tabela 3, para 24 horas de contato e 1,0 x 104 células.mL-1, 12,5% dos residuais apresentaram CRL de acordo com a referida portaria, enquanto que para densidade 1,0 x 106 células.mL-1 aproximadamente 21% dos residuais foram satisfatórios.
Dessa forma, pode-se afirmar que o consumo de cloro foi considerável para ambas as concentrações tanto com 30 minutos quanto 24 horas de contato e a aplicação de baixas doses do oxidante mostraram um maior consumo de cloro. Segundo Pereira (2005), a elevada demanda de cloro pode ser justificada pelo uso do mesmo para a destruição de bainhas de mucilagem, que envolve os aglomerados de células, e para as células liberadas das mesmas.
Agrizzi (2011), que utilizou em seu estudo matéria orgânica natural (MON) proveniente do Rio Sahy (Espírito Santo), obteve um residual equivalente a 0,02 mg.L-1 e 4,49 mg.L-1 para doses de 3 mg.L-1 e 8 mg.L-1, respectivamente. Tais resultados mostram situação similar aos resultados apresentados, em que uma menor dose ocasiona um menor residual e, consequentemente, maior consumo de oxidante.
O estudo de Zamyadi et al. (2013), com a mesma espécie de cianobactéria e em condições análogas, observou que o número de células em água ultrapura determina a demanda de cloro na mesma. Após 60 minutos de contato, a cloração ocasionou 76% da lise celular. Desse modo, uma maior concentração de cianobactérias foi relacionada à maior liberação de carbono orgânico dissolvido (COD) que promoveu elevado consumo de cloro em situação semelhante com os resultados obtidos neste estudo.
Fan et al. (2013), em estudo com mesmo oxidante e espécie de cianobactéria, concluíram que doses de cloro ocasionam perda de integridade da membrana das células, inclusive com aplicação de doses mais baixas; sendo que, para dose de 3 mg.L-1, 97% das células apresentaram lise nos primeiros minutos de contato, o que explica os danos observados nas células após a cloração das amostras neste estudo. Ainda, de acordo com os autores, outros oxidantes como ozônio, permanganato de potássio, sulfato de cobre e peróxido de hidrogênio também mostraram grande eficiência na destruição da integridade celular, todavia o cloro apresentou ser o mais danoso às células.
No estudo com a espécie Anabaena circinalis, Zamyadi et al. (2010) mostram, através da fluorescência, que antes da cloração 100% das células eram classificadas como vivas e ativas. Depois, houve uma redução do número total de células de 9% e 15% para doses de 2 mg.L-1 e 3 mg.L-1, respectivamente, e as células remanescentes apresentavam membranas danificadas ou metabolismo inativo. Ao comparar os resultados obtidos pelos autores com o estudo de Daly, Ho e Brookes (2007), conclui-se que as células da espécie de estudo são mais vulneráveis ao cloro quando comparadas às células de Microcystis aeruginosa.
Com a aplicação de doses elevadas nos ensaios para análise de demanda para potencial de formação, era esperado um residual entre 3 e 5 mg.L-1, conforme estabelecido pela APHA (2012). Como pode ser observado na Tabela 4, o consumo de cloro foi significativo e, apesar de alguns ensaios para 1,0 x 104 células.mL-1 com dose de 20 mg.L-1 apresentarem valores em acordo com o esperado, os demais residuais apresentaram valores relativamente baixos.
Em estudo com condições semelhantes, Paschoalato (2005) relata que encontrou CRL entre 3,5 e 5 mg.L-1 para doses de 15,0; 17,5 e 20 mg.L-1 e Pereira (2005) observou um residual de 4 mg.L-1 para dose de 10 mg.L-1. Entretanto, resultados parecidos com os obtidos neste estudo são apresentados por Schuck (2004), que utilizando o DPD para análise de CRL, encontrou valores consideravelmente baixos e por Agrizzi (2011) que, mesmo usando equipamentos de maior precisão, encontrou valores abaixo do esperado para potencial de formação, como 2,3 mg.L-1 e 0,05 mg.L-1 para as doses 15 mg.L-1 e 20 mg.L-1, respectivamente.
Além de a cloração promover a liberação de substâncias, o estudo de Pietsch, Bornmann e Schmidt (2002) relaciona a oxidação das cianobactérias e a liberação de substâncias intracelulares com os processos usados no tratamento de água para abastecimento. Os autores afirmam que a liberação significativa de toxinas pode estar relacionada ao acúmulo de células de cianobactérias em alguns processos usados nas ETAs, como, por exemplo, tanque de sedimentação, filtros e clarificadores. Ainda, além da liberação de toxinas na pré-cloração, a floculação e filtração também promovem essa liberação devido às turbulências na tubulação e pressão nos filtros; e o processo de floculação, segundo os autores, foi capaz de eliminar células de Microcystis aeruginosa, mas não a microcistina MC-LR. De acordo com Zamyadi et al. (2012b), é importante que os operadores das ETAs lidem com a possibilidade de formação de subprodutos após a pré-cloração mesmo que, com base nos resultados obtidos pelos autores, ela seja uma prática viável, considerando os critérios de concentração de toxinas e subprodutos para água de abastecimento.
De acordo com Fang et al. (2010), a alta liberação de COD, nitrogênio orgânico e material celular está relacionado ao alto consumo de cloro. Sendo assim, uma vez que as amostras apresentaram resíduos provavelmente de lise celular e células com danos em suas estruturas, o alto consumo de cloro neste estudo pode ser justificado pela reação do oxidante com substâncias intracelulares, o que pode contribuir para a formação de SOHs como trialometanos (TAMs) e ácidos haloacéticos (AHAs) (BOND et al., 2009; NGUYEN et al., 2005).
4 Conclusão
A análise do consumo de cloro buscou reproduzir o efeito da cloração de florações. A quantificação do cloro residual livre pelo método colorimétrico foi possível, e os resultados da análise da demanda de cloro mostraram um elevado consumo do oxidante e baixo residual, que pode ser explicado pela reação da MOE e MOI com o cloro. A concentração 1x104 células.mL-1 de Microcystis aeruginosa apresentou, em média, melhores resultados para todas as dosagens utilizadas e tempos de contato de 30 minutos e 24 horas que a concentração 1x106 células.mL-1, uma vez que se obtiveram mais residuais em conformidade com as concentrações estabelecidas pela Portaria de Consolidação 5/2017. Para o potencial de formação, ambas as concentrações não mostraram valores de CRL em conformidade com o estabelecido pela APHA (2012).
Referências
ACERO, J. L.; RODRIGUEZ, E.; MERILUOTO, J. Kinetics of reactions between chlorine and the cyanobacterial toxins microcystins. Water Research, v. 39, n. 8, p. 1628-1638, abr. 2005.
AGRIZZI, A. D. Avaliação da formação de Trialometanos considerando o uso do cloro e do permanganato de potássio como pré-oxidantes em água de abastecimento. 2011. 139 f. Dissertação (Mestrado em Engenharia Ambiental) – Centro Tecnológico, Universidade Federal do Espírito Santo, Vitória, 2011.
APHA. AMERICAN PUBLIC HEALTH ASSOCIATION. Standard Methods for the Examination of Water and Wastewater. 22. ed. Washington, D.C., 2012. 1496 p.
ARAGÃO, N. K. C. V. Taxonomia, distribuição e quantificação de populações de cianobactérias em reservatórios do estado de Pernambuco (Nordeste do Brasil). 2011. 159 f. Dissertação (Mestrado em Botânica) - Departamento de Biologia, Universidade Federal Rural de Pernambuco, Recife, 2011.
BOND, T. et al. Disinfection byproduct formation and fractionation behavior of natural organic matter surrogates. Environmental Science and Technology, v. 43, n.15, p. 5982-5989, jul. 2009.
BORTOLI, S.; PINTO, E. Cianotoxinas: características gerais, histórico, legislação e métodos de análises. In: POMPÊO, M. et al. (Org.). Ecologia de reservatórios e interfaces. São Paulo: Instituto de Biociências da Universidade de São Paulo, 2015. cap. 21, p. 321-339.
BRASIL. Portaria de Consolidação Ministério da Saúde n. 5, de 28 de setembro de 2017. Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde. Diário Oficial da União, Brasília, 3 out. 2017.
CAMACHO, F. P. et al. Remoção de cianobactérias e cianotoxinas em águas de abastecimento pela associação de flotação por ar dissolvido e nanofiltração. E-xacta, Belo Horizonte: Editora UniBH, v. 5, n. 2, p. 127-138, 2012.
CHENG, X. et al. Effects of oxidative and physical treatments on inactivation of Cylindrospermopsis raciborskii and removal of cylindrospermopsin. Water Science & Technology, v. 60, p. 689-697, 2009.
CETESB. COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO. Manual de Cianobactérias Planctônicas: Legislação, Orientações para o Monitoramento e Aspectos Ambientais. São Paulo, 2013. 56 p.
DALY, R. I.; HO, L.; BROOKES, J. D. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation. Environmental Science & Technology, v. 41, p. 4447-4453, 2007.
DI BERNARDO, L.; PAZ, L. P. S. Seleção de Tecnologias de Tratamento de Água. São Carlos: Editora LDiBe, 2008. v. 2, 682 p.
FAN, J. et al. Evaluating the effectiveness of copper sulphate, chlorine, potassium permanganate, hydrogen peroxide and ozone on cyanobacterial cell integrity. Water Research, v. 47, n. 14, p. 5153-5164, 2013.
FANG, J. et al. Characterization of algal organic matter and formation of DBPs from chlor (am) ination. Water research, v. 44, n. 20, p. 5897-5906, dez. 2010. Disponível em: https://www.researchgate.net/publication/46008994_Characterization_of_algal_organic_matter_and_formation_of_DBPs_from_chloramination. Acesso em: 10 dez. 2016.
FREITAS, T. C. Análise Qualitativa e Toxicológica de uma Floração de Cianobactérias na Lagoa do Gambá em Ouro Preto, MG, em uma síntese da Ocorrência de Floração de Cianobactérias no Brasil. Revista Brasileira de Recursos Hídricos, v. 17, n. 3, p. 17-28, jul./set. 2012.
FUNASA. FUNDAÇÃO NACIONAL DE SAÚDE. Cianobactérias/cianotoxinas: procedimentos de coleta, preservação e análise. Brasília: Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador, 2015. 106 p.
FUNASA. FUNDAÇÃO NACIONAL DE SAÚDE. Potenciais fatores de risco à saúde decorrentes da presença de subprodutos de cloração na água utilizada para consumo humano. Brasília: Ministério da Saúde, 2007. 126 p.
JACINAVICIUS, F. R. et al. Manual para Cultivo de Cianobactérias. 2013. Disponível em: http://botanica.sp.gov.br/files/2013/09/virtuais_4cianobact%C3%A9rias.pdf. Acesso em: 9 set. 2015.
KOMÁREK, J. et al. Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia, v. 86, p. 295-335, 2014.
KOMÁREK, J.; KOMÁRKOVÁ, J. Review of the European Microcystismorphospecies (Cyanoprokaryotes) from nature. Czech Phycology, v. 2, p. 1-24, 2002.
LEAL, A. C.; SOARES, M. C. P. Hepatotoxicidade da Cianotoxina microcistina. Revista da Sociedade Brasileira de Medicina Tropical, Uberaba, v. 37, supl. 2, p. 84-89, 2004.
LIBÂNIO, M. Fundamentos de Qualidade e Tratamento de Água. 3. ed. rev. e ampl. Campinas: Editora Átomo, 2010. v. 1, 444 p.
MA, M. et al. Effects and mechanisms of pre-chlorination on Microcystis aeruginosa removal by alum coagulation: Significance of the released intracellular organic matter. Separation and Purification Technology, v. 86, p. 19-25, fev. 2012.
MACEDO, C. F.; SIPAÚBA-TAVARES, L. H. Eutrofização e Qualidade da Água na Piscicultura: Consequências e Recomendações. Boletim do Instituto da Pesca, São Paulo, v. 36, n. 2, p. 149-163, 2010.
MIRANDA, M. A. S. Ocorrência de Cianobactérias e Cianotoxinas na Água de Cinco Importantes Rios no Estado de Minas Gerais – Brasil. 2014. 78 f. Dissertação (Mestrado em Biologia e Gestão da Qualidade da Água) – Departamento de Biologia, Universidade do Porto, Porto, 2014.
MONDARDO, R. I.; SENS, M. L.; MELO FILHO, L. C. Pré-tratamento com cloro e ozônio para remoção de cianobactérias. Engenharia Sanitária e Ambiental, v. 11, n. 4, p. 337-342, out./dez. 2006.
NGUYEN, M. L. et al. Characteristics and reactivity of alga e produced dissolved organic carbon. Journal of Environmental Engineering, v. 131, n. 11, p. 1574-1582, nov. 2005.
NICHOLSON, B. C.; ROSITANO, J.; BURCH, M. D. Destruction of cyanobacterial peptide hepatotoxins by chlorine and chloramine. Water Research, v. 28, n. 6, p. 1297-1303, jun. 1994.
PASCHOALATO, C. F. P. R. Efeito da pré-oxidação, coagulação, filtração e pós-cloração na formação de subprodutos orgânicos halogenados em águas contendo substâncias húmicas. 2005. 291 f. Tese (Doutorado em Engenharia Civil) – Escola de Engenharia de São Carlos, Universidade de São Paulo, São Carlos, 2005.
PEREIRA, G. G. Remoção de células de Microcystis sp por pré-cloração, coagulação, filtração direta e pós-cloração em escala de bancada. 2005. 95 f. Dissertação (Mestrado em Engenharia Hidráulica e Saneamento) – Escola de Engenharia de São Carlos, Universidade de São Paulo, São Carlos, 2005.
PIETSCH, J.; BORNMANN, K.; SCHMIDT, W. Relevance of intra- and extracellular cyanotoxins for drinking water treatment. Acta Hydrochimica and Hydrobiologica, v. 30, n. 1, p. 7-15, 2002.
PROSAB. PROGRAMA DE PESQUISAS EM SANEAMENTO BÁSICO. Métodos alternativos de desinfecção da água. 1. ed. São Carlos: Rima artes e textos, 2001. 149 p.
SANT’ANNA, C. L. et al. Planktic Cyanobacteria from São Paulo State, Brazil: Chroococcales. Revista Brasileira de Botânica, v. 27, n. 2, p. 213-227, abr./jun. 2004.
SANT’ANNA, C. L. et al. Review of toxic species of Cyanobacteria in Brazil. Algological Studies, v. 126, p. 251-265, abr. 2008.
SCHUCK, C. A. Ocorrência de Trihalometanos e Ácidos Haloacéticos na desinfecção de efluentes tratados biologicamente. 2004. 98 f. Dissertação (Mestrado em Química) - Programa de Pós-Graduação em Química, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2004.
ZAMYADI, A. et al. Fate of toxic cyanobacterial genera from natural bloom events during ozonation. Water Research, v. 73, p. 204-215, 2012(a).
ZAMYADI, A. et al. Chlorination of Microcystis aeruginosa: Toxin release and oxidation, cellular chlorine demand and disinfection by-products formation. Water Research, v. 47, p. 1080-1090, 2013.
ZAMYADI, A. et al. Fate of toxic cyanobacterial cells and disinfection by-products formation after chlorination. Water Research, v. 46, p. 1524-1535, 2012(b).
ZAMYADI, A. et al. Release and oxidation of cellbound saxitoxins during chlorination of Anabaena circinalis cells. Environmental Science & Technology, v. 44, p. 9055-9061, 2010.
Notas de autor