Artigos originais
Perfil químico, flavonoides totais, atividade antioxidante e citotóxica dos extratos de Guapira pernambucensis
Chemical profile, total flavonoids, antioxidant and cytotoxic activity of the extracts of Guapira pernambucensis
Perfil químico, flavonoides totales, actividad antioxidante y citotóxica de los extractos de Guapira pernambucensis
Perfil químico, flavonoides totais, atividade antioxidante e citotóxica dos extratos de Guapira pernambucensis
Vértices (Campos dos Goitacazes), vol. 21, núm. 1, 2019
Instituto Federal de Educação, Ciência e Tecnologia Fluminense

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 21 Septiembre 2018
Aprobación: 16 Enero 2019
Resumo: As folhas da espécie Guapira pernambucensis foram submetidas à análise do perfil químico e avaliação das atividades antioxidante e citotóxica. Foi identificada a presença de triterpenos, esteroides, alcaloides, flavonoides, proantocianidinas e fenólicos. A análise da atividade antioxidante e de flavonoides mostrou uma CE50 = 280,90 ± 1,15 μg/mL e 20,4 ± 0,50 mg ER/g de extrato, respectivamente. A citotoxicidade frente às larvas de Artemia salina apresentou uma DL50 = 171 μg/mL. O estudo mostrou uma baixa capacidade antioxidante, apesar da presença de flavonoides, e uma moderada citotoxicidade.
Palavras-chave: Fitoquímica, Potencial antioxidante, Artemia salina.
Abstract: The leaves of the species Guapira pernambucensis were submitted to chemical profile analysis and evaluation of antioxidant and cytotoxic activities. The presence of triterpenes, steroids, alkaloids, flavonoids, proanthocyanidins and phenolics was identified. The antioxidant activity and flavonoid analysis showed an EC50 = 280.90 ± 1.15 μg/mL and 20.4 ± 0.50 mg ER/g extract, respectively. The cytotoxicity against Artemia salina larvae presented an LD50 = 171 μg/mL. The study showed a low antioxidant capacity, despite the presence of flavonoids, and a moderate cytotoxicity.
Keywords: Phytochemistry, Antioxidant potential, Artemia salina.
Resumen: Las hojas de la especie Guapira pernambucensis fueron sometidas al análisis del perfil químico y evaluación de las actividades antioxidante y citotóxica. Se identificó la presencia de triterpenos, esteroides, alcaloides, flavonoides, proantocianidinas y fenólicos. El análisis de la actividad antioxidante y de flavonoides mostró una CE50 = 280,90 ± 1,15 μg / ml y 20,4 ± 0,50 mg ER / g de extracto, respectivamente. La citotoxicidad frente a las larvas de Artemia salina presentó una DL50 = 171 μg / mL. El estudio mostró una baja capacidad antioxidante, a pesar de la presencia de flavonoides, y una moderada citotoxicidad.
Palabras clave: Fitoquímica, Potencial antioxidante, Artemia salina.
1 Introdução
A vegetação de restinga é definida como um grupo de comunidade vegetal associada a depósitos arenosos costeiros e ambientes rochosos litorâneos (BRASIL, 2009). Parte dessa vegetação possui aplicação terapêutica, sendo utilizada principalmente por comunidades pesqueiras. Entre as espécies presentes em restingas mais empregadas por essas comunidades estão o bajirú (Chrysobalanusicaco L.), aplicado no tratamento de diabetes e pedras nos rins, a pitanga (Eugenia uniflora L.), usada como antitérmico e antidiarreica, e a aroeira (Schinusterebinthifolius R.), empregada como adstringente e cicatrizante (FONSECA-KRUEL et al., 2006).
Na literatura existem estudos que relatam algumas atividades biológicas para essas espécies. O bajiru apresentou ação hipoglicemiante (CASTILHO; SOUZA; GUIMARAES, 2000); a pitanga, atividades antibiótica, antidiarreica e analgésica (SOUZA et al., 2004; SCHUMEDA et al., 1987); e a aroeira, propriedades cicatrizantes (LUCENA, 2006).
A utilização popular e a evidência científica de benefícios atribuídos às plantas de áreas de restinga demonstram a importância de estudos químico/biológicos de espécies nativas desse ecossistema.
Dentro desse contexto, destaca-se a espécie Guapira pernambucensis (Nyctaginaceae), conhecida popularmente como farinha-seca-do-litoral, farinha-seca e carne-de-vaca (SOUZA; JARDIM; COELHO, 2016). De forma geral, a espécie apresenta hábito arbustivo com até 2 m, suas folhas são opostas e glabras. As flores de cor creme esverdeada com estames alvos são diclinas com botão floral tubuloso podendo ser estaminadas ou pistiladas. Os frutos vinosos possuem forma globular, antocárpio com coroa fechada ou ereta (Figura 1) (FURLAN; GIULIETTI, 2014).

Figura 1.
Espécime de G. pernambucensis
Fonte: Mercadante, M. Disponível em: https://www.flickr.com/photos/mercadanteweb/31161762124
Seu habitat se concentra na maior parte do litoral brasileiro em praias, ilhas, dunas e restingas (Figura 2). Sendo endêmica do Brasil, pode ser encontrada nos estados da região Sudeste e Nordeste, com exceção dos estados de Minas Gerais, Piauí e Ceará (SÁ, 2015; FURLAN; GIULIETTI, 2014).
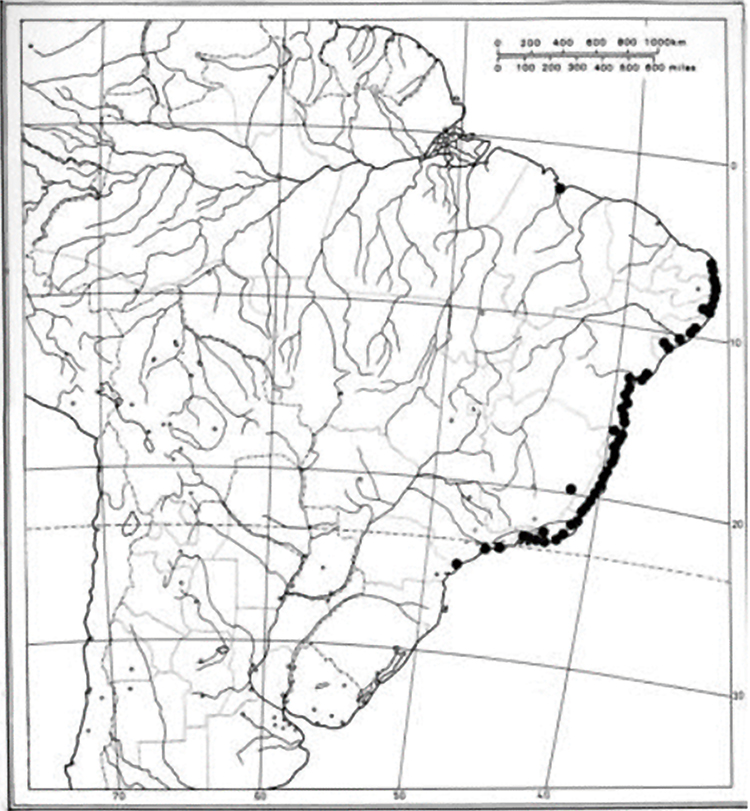
Figura 2.
Distribuição geográfica da espécie G. pernambucensis no Brasil
Fonte: Furlan e Giulietti (2014)
Tradicionalmente, os frutos são empregados como fonte de alimento e também como corante (SANTOS et al., 2009), porém na literatura não existem relatos de aplicações da espécie na medicina popular.
Estudos fitoquímicos realizados com espécies do gênero são raros na literatura, porém para G. noxia, espécie mais estudada do gênero, foram verificadas atividades antiúlcera, antimicrobiana e imunomodulatória, e a presença de flavonoide, alcaloide e ciclitol (SEVERI, 2007). A espécie G. graciliflora foi considerada como uma potencial fonte de compostos bioativos eficazes no tratamento de infecções (ARAÚJO, 2014). Até o momento não há relatos na literatura sobre estudos fitoquímicos da espécie G. pernambucensis; sendo assim, esta é a primeira abordagem sobre seu perfil químico, atividade antioxidante e citotóxica.
2 Materiais e métodos
2.1 Procedimentos experimentais gerais
O radical DPPH (2,2’-difenil-1-picril-hidrazila) foi adquirido da Sigma Aldrich e a rutina da Merck. Os demais solventes e reagentes utilizados nas análises foram analiticamente puros da marca Synth.
2.2 Equipamentos
A concentração dos extratos e frações foi efetuada em evaporador rotativo, Fisatom 802. As soluções aquosas foram liofilizadas em liofilizador Thermo Savant. Os espectrofotômetros UV-Vis utilizados foram o Bel Photonics (modelo 1105) e o Shimadzu (modelo UV-1800).
2.3 Coleta e Identificação do material vegetal
O material vegetal foi coletado na restinga de Grussaí/Iquipari no município de São João da Barra – RJ, em janeiro de 2001. A exsicata foi depositada sob o número HUENF 5911 e identificada por especialistas do Herbário da Universidade Estadual do Norte Fluminense Darcy Ribeiro (UENF).
2.4 Obtenção dos extratos brutos
As folhas (803,7 g), após secas, moídas e pesadas, foram submetidas à maceração exaustiva utilizando os solventes hexano e metanol em ordem crescente de polaridade. Os extratos foram filtrados e evaporados sob pressão reduzida, transferidos para frascos previamente pesados e mantidos em capela de exaustão até peso constante.
Esse procedimento forneceu 0,33 g (0,04%) de extrato em hexano e 35,12 g (4,37%) de extrato em metanol.
2.5 Triagem fitoquímica
O perfil químico dos extratos brutos (em hexano e metanol) foi avaliado qualitativamente para identificação dos metabólitos secundários (Tabela 1).
| Metabólito | Teste | Referência |
| Triterpenos e Esteroides | Reação de Liebermann-Buchard | BARBOSA et.al., 2004 |
| Alcaloides | Reagente de Dragendorff | BARBOSA et.al., 2004 |
| Fenólicos em geral | Reação de FeCl3 | BARBOSA et.al., 2004 |
| Flavonoides | Reação de AlCl3 | Mouco; Bernardino; Cornélio, 2003 |
| Flavonoides | Reação de NaOH | Mouco; Bernardino; Cornélio, 2003 |
| Flavonoides | Reação de Shinoda | Mouco; Bernardino; Cornélio, 2003 |
| Taninos Condensados | Método da Butanólise | Santos; Mello, 2003 |
2.6 Análise quantitativa do teor de flavonoides totais
A quantificação de flavonoides no extrato metanólico foi feita utilizando-se o método do AlCl3 (RIO, 1996). A análise baseia-se na formação do complexo flavonoide/alumínio que pode ser observado pela intensificação da cor e da absorção (efeito hipercrômico e desvio batocrômico) quando analisado por espectrofotometria na região do ultravioleta-visível (UV-Vis) (MARQUES et al., 2012).
O desvio batocrômico ocorre porque o cátion Al3+ forma complexos estáveis com as hidroxilas livres nas posições 3-, 5- e 3’-, 4’- no esqueleto flavonoídico, ocasionando a extensão do sistema conjugado. Dessa maneira, é possível determinar o teor de flavonoides evitando-se a interferência de outras substâncias fenólicas, principalmente os ácidos fenólicos, pois estes apresentam comprimentos de onda inferiores ao do complexo flavonoide – Al3+(MARQUES et al., 2012).
Foi construída uma curva de calibração com o padrão rutina com concentrações na faixa de 6,8 a 17,0 μg/mL. A cada uma das concentrações foi acrescentado 1,0 mL da solução de cloreto de alumínio 5% em metanol (m/v). A uma alíquota de 15 mL da solução do extrato (1,0 mg/mL) adicionou-se 1,0 mL da solução de AlCl3, em seguida o volume foi completado para 50 mL com metanol.
As medidas foram feitas em espectrofotômetro UV-Vis a 425 nm. O resultado obtido foi expresso em miligramas equivalentes a rutina por grama de extrato (mg ER/g).
2.7 Análise quantitativa da atividade antioxidante
A literatura apresenta diversos métodos empregados na avaliação da atividade antioxidante de extratos, frações e substâncias puras. No entanto, o mais utilizado consiste em avaliar a atividade sequestradora do radical livre 2,2’-difenil-1-picril-hidrazila (DPPH). Na análise foi empregado o método descrito por Sousa e colaboradores (2007). O DPPH é um radical estável à temperatura ambiente apresentando coloração violeta quando em solução e comprimento de onda máximo (λmax) em aproximadamente 515 nm. Quando em contato com uma substância doadora de hidrogênio ou elétrons, ele é reduzido formando o difenil-pricril-hidrazina de coloração amarela com consequente perda da absorção (MENSOR et al., 2001).
A curva de calibração foi construída a partir dos valores da absorbância das soluções de DPPH nas concentrações de 1,0 μg/mL a 40,0 μg/mL, utilizando metanol como branco.
As soluções metanólicas do extrato em metanol e do controle positivo (rutina) foram preparadas nas concentrações de 25,0 μg/mL a 250,0 μg/mL. Como branco utilizou-se a mistura de 2,7 mL de metanol e 0,3 mL da solução do extrato. Os valores de absorbância das misturas reacionais (0,3 mL da amostra + 2,7 mL da solução de DPPH 40,0 μg/mL) em todas as concentrações testadas, após 30 minutos de repouso, foram convertidos em porcentagem de atividade antioxidante (%AA), determinada pela equação:
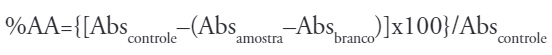
Onde: Abscontrole é a absorbância da solução metanólica de DPPH a 40 μg/mL e Absamostra é a absorbância da mistura reacional (DPPH + amostra).
As medidas das absorbâncias foram feitas em espectrofotômetro UV-Vis no comprimento de onda 515 nm. Os resultados obtidos foram expressos em porcentagem de atividade antioxidante (%AA) e em concentração efetiva para reduzir a concentração inicial de DPPH em 50% (CE50).
2.8 Análise da toxicidade frente às larvas de Artemia salina
A análise foi realizada segundo a metodologia proposta por Meyer et al. (MEYER et al., 1982). O bioensaio é considerado simples e permite determinar a dose letal para reduzir a população de náuplios em 50% (DL50). No procedimento utilizaram-se cinco soluções do extrato metanólico nas concentrações de 0,22; 0,44; 0,89; 1,33 e 2,22 mg/mL. O extrato foi solubilizado na mistura água marinha/DMSO 1% na proporção 3:2 (v/v).
Aproximadamente 15 larvas de A. salina foram colocadas em contato com cada concentração do extrato testada. Após 24 horas, foi realizada a contagem dos indivíduos mortos.
As análises foram feitas em triplicata e os dados obtidos tratados estatisticamente pelo método log-Probit para determinação dos valores de DL50.
2.9 Análise Estatística
Os experimentos foram feitos em triplicata e os resultados apresentam a média de três experimentos distintos e seu desvio padrão.
3 Resultados e Discussão
A avaliação fitoquímica é considerada um desafio quando se verifica o crescente interesse por fitoterápicos, sendo papel do pesquisador investigar de maneira cuidadosa espécies com possíveis aplicações terapêuticas (SILVA; MIRANDA; CONCEIÇÃO, 2010). O estudo fitoquímico permite identificar classes de metabólitos presentes em espécies vegetais com possíveis aplicações medicinais (SIMÕES, 2001).
A avaliação fitoquímica preliminar dos extratos brutos da espécie G. pernambucensis utilizando testes químicos qualitativos possibilitou identificar o perfil químico dos metabólitos presentes na espécie.
A reação de Libermann-Buchard é empregada na identificação de triterpenos e esteroides. Quando os reagentes são adicionados à amostra contendo esses metabólitos, ocorre uma mudança de coloração do meio reacional. O desenvolvimento da coloração esverdeada se dá devido à formação de um derivado sulfônico que absorve em torno de 416 nm, indicando resultado positivo para o teste (BARBOSA et al., 2004).
Os ensaios para identificação de alcaloides, fenólicos, flavonoides e proantocianidinas não foram realizados com o extrato em hexano em virtude da diferença de polaridade do extrato com os solventes empregados nos testes.
A presença de átomos de nitrogênio em uma molécula confere a ela um caráter básico, o que possibilita a formação de sal quando em meio ácido. O reagente de Dragendorff é uma solução de iodeto de bismuto e potássio [K(BiI4)] em ácido diluído e, quando em presença de alcaloides, forma precipitado laranja avermelhado (DENNY et al., 2007; BARBOSA et al., 2004).
A identificação de fenóis foi efetuada por meio da reação com FeCl3. Fenólicos em geral na presença de FeCl3 formam um complexo colorido cuja coloração pode variar entre violeta, azul, verde e amarelo-castanho, dependendo do tipo de substância fenólica analisada (BARBOSA et al., 2004).
Para a verificação da presença de flavonoides, foram empregadas as reações com AlCl3 e NaOH, reagentes específicos para a identificação dessa classe de metabólito.
Os cátions Al3+ formam complexos estáveis com as hidroxilas em posição orto presentes nos flavonoides aumentando o sistema conjugado, enquanto que o NaOH, por ser uma base forte, é capaz de ionizar todas as hidroxilas presentes no esqueleto flavonoídico. Em ambos os testes ocorre um desvio batocrômico e um efeito hipercrômico. O resultado da reação com AlCl3 pode ser observado pela intensificação da fluorescência dos extratos analisados. Na reação com o NaOH observa-se a intensificação da cor (MOUCO; BERNADINO; CORNÉLIO, 2003).
Na reação de Shinoda ocorre a oxidação do magnésio com liberação de gás hidrogênio sendo aplicada na identificação de flavonoides. O resultado da reação é avaliado pela mudança de coloração. O surgimento da coloração róseo-avermelhada indica a presença de flavononas, enquanto a coloração alaranjada, a presença de flavonas (MOUCO; BERNADINO; CORNÉLIO, 2003).
O método da butanólise é citado como o melhor ensaio para determinar a presença de proantocianidinas dada sua alta seletividade (HAGERMAN; BUTLER, 1989). O teste se fundamenta na reação colorimétrica com intensa absorção na região de 550 nm após o tratamento com ácido. Em meio ácido, alcoólico e a quente, as proantocianidinas liberam antocianidinas em razão da quebra das ligações entre as unidades monoméricas. No extrato metanólico antes e após a reação, a leitura das absorbâncias (Figura 3) permitiu observar o aparecimento de uma banda em 548 nm (pico 1), confirmando a presença de antocianidinas (SANTOS; MELLO, 2003).
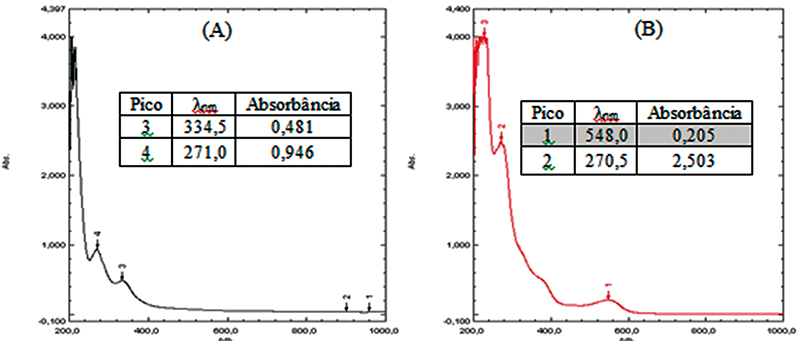
Figura 3.
Espectros de UV-Vis antes (A) e depois (B) da reação de butanólise do extrato metanólico de G. pernambucensis
Fonte: Os autores
Os resultados observados (mudança de coloração e/ou formação de precipitado) para a espécie G. pernambucensis estão resumidos na Tabela 2. Para o extrato em hexano, verificou-se a presença de esteroides e, no extrato metanólico, a presença de alcaloides, flavonoides, proantocianidinas e fenólicos em geral.
| Reativo | Metabólito secundário | Extrato em Hexano | Extrato em MeOH | Alteração observada |
| L. Buchardt | Esteroides | + | - | Mudança de coloração |
| Reagente deDragendorf | Alcaloides | * | + | Formação de precipitado |
| FeCl3 2% | Fenólicos | * | + | Mudança de coloração |
| Reativo | Metabólito secundário | Extrato em Hexano | Extrato em MeOH | Alteração observada |
| AlCl3 5% | Flavonoides | * | + | Fluorescência sob luz UV |
| NaOH 5% | Flavonoides | * | + | Mudança de coloração |
| Reação de Shinoda | Flavonoides | * | + | Mudança de coloração |
| Butanólise | Proantocianidinas | * | + | Mudança de coloração e absorção em 548 nm |
Os compostos fenólicos presentes em plantas podem ser divididos em várias classes, dentre elas destacam-se os ácidos fenólicos, flavonoides e taninos condensados e hidrolisáveis (NACZK; SHAHIDI, 2004). Tendo em vista que o extrato metanólico apresentou resultados positivos para fenólicos e flavonoides, realizou-se, então, a quantificação do seu teor de flavonoides totais.
Na análise, os valores de absorbância em triplicata medidos a 425 nm foram utilizados na construção da curva de calibração (absorbância versus concentração), que forneceu a equação da reta y = 0,0053x – 0,0175 (R2 = 0,9755). Por intermédio desta, foi possível calcular o teor de flavonoides totais para o extrato metanólico, cujo valor foi de 20,4 ± 0,50 mg ER/g do extrato.
Devido à escassez de trabalhos com espécies do mesmo gênero, comparar os teores de flavonoides totais tem se mostrado uma tarefa difícil. Severi (2007) verificou em G. noxia 133,0 mg/g no extrato metanólico. Chaves (2012) realizou um estudo com a espécie G. graciliflora, comparando os teores de flavonoides totais em diferentes estações do ano (verão e inverno), e observou concentrações de 0,00756 mg/g e 0,0145 mg/g no extrato etanólico no verão e inverno, respectivamente. Sendo assim, o teor encontrado no presente trabalho é cerca de 6 vezes menor ao valor encontrado por Severi (2007) e aproximadamente 1.000 vezes maior que o teor indicado por Chaves (2012).
Diversas substâncias são consideradas antioxidantes naturais, incluindo os fenólicos. Entre os compostos fenólicos, os flavonoides se destacam pela capacidade de atuar como proteção contra danos oxidativos causados por radicais livres (YUNES; CALIXTO, 2001). Em vista da constatação da presença de flavonoides no extrato metanólico, procedeu-se à determinação da atividade antioxidante. Empregando-se os valores de porcentagem de atividade antioxidante versus concentração (Figura 4), obteve-se a equação da reta para o padrão positivo rutina e para a amostra, possibilitando, assim, o cálculo dos valores de CE50.
A rutina apresentou uma CE50 = 50,06 ± 0,29 μg/mL, e o extrato metanólico uma CE50 = 280,90 ± 1,15 μg/mL. Quando comparados, os resultados demonstram que o extrato metanólico apontou uma capacidade antioxidante cerca de cinco vezes menor que o padrão rutina. Ressalta-se que quanto menor o valor de CE50 maior é o potencial antioxidante da amostra.
O valor de CE50 obtido para a espécie em estudo foi similar ao valor descrito por Cabral (2014) para a espécie G. laxa (CE50 295,68 ± 6,29).
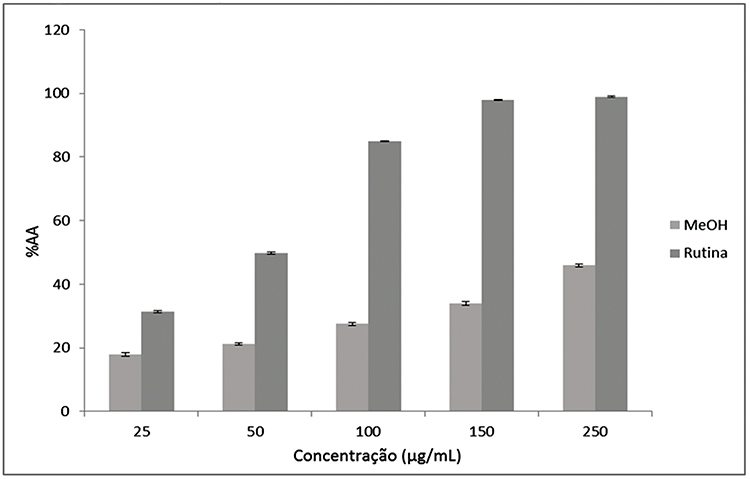
Figura 4.
Porcentagem de Atividade Antioxidante do padrão positivo (rutina) e da amostra (extrato metanólico) das folhas de G. pernambucensis pelo método do DPPH
Fonte: Os autores
A relação entre a presença de flavonoides e a potencial antioxidante é dependente da conformação estrutural, da posição e do número de grupos hidroxilas presentes na molécula (MENSOR et al., 2001); por exemplo, a presença de hidroxilas na posição orto do anel B do esqueleto flavonoídico potencializa sua ação antioxidante (Figura 5) (WU et al., 2009; VAN ACKER et al., 1996).
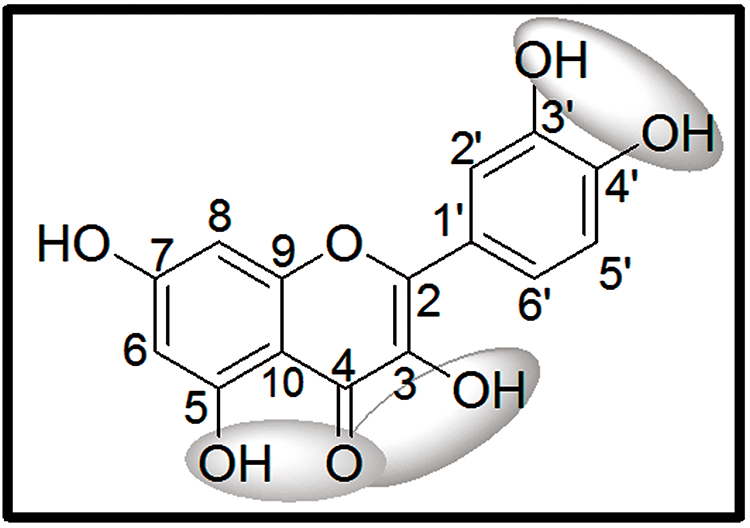
Figura 5.
Características estruturais responsáveis por potencializar a ação antioxidante
Fonte: WU et al.(2009) e VAN ACKER et al.(1996)
Cao, Sofic e Prior (1997) verificaram que flavonoides monoidroxilados demonstram baixo potencial antioxidante, como por exemplo, flavonas com apenas uma hidroxila na posição 3, 6, 3’ ou 4’ e flavononas monoidroxilada na posição 2’, 3’, 4’ ou 6’ (BARREIROS; DAVID; DAVID, 2006). Segundo Barreiros, David e David (2006), a estabilidade do radical livre flavonoil depende da deslocalização do elétron desemparelhado.
Uma vez que o teste qualitativo com NaOH indicou a presença de flavonas no extrato, supõe-se que a maior parte desses flavonoides são monoidroxilados, justificando a baixa atividade antioxidante observada.
Quanto à atividade citotóxica, pesquisadores definem o teste de toxicidade frente às larvas de A. salina como uma avaliação preliminar que indica a possibilidade de o extrato bruto ou fração apresentar algumas atividades biológicas como, por exemplo, atividades antifúngica e antimicrobiana (SIQUEIRA et al., 1998).
A avaliação da atividade citotóxica foi realizada apenas com o extrato metanólico, uma vez que o extrato hexânico não foi solúvel na mistura de solventes empregada (DMSO/H2O) no teste.
Os resultados apresentados frente às larvas do microcrustáceo foram reunidos, e os dados, tratados estatisticamente pelo método log-Probit para se obterem os valores de DL50. Quanto menor o valor de DL50 maior será a atividade citotóxica, indicando um potencial biológico (MEYER et al., 1982).
Os extratos são classificados como de alta citotoxicidade quando apresentam DL50 menor que 100 μg/mL, moderada entre 100 e 500 μg/mL, e fraca de 500 a 1000 μg/mL (NGUTA et al., 2012); logo, o extrato metanólico das folhas de G. pernambucensis apresentou uma atividade citotóxica moderada com uma DL50 = 171 μg/mL.
4 Conclusão
A avaliação preliminar expôs informações relevantes sobre o perfil químico dos extratos das folhas da G. pernambucensis, indicando a presença de triterpenos, esteroides, alcaloides, fenólicos, flavonoides e proantocianidinas. A determinação do teor de flavonoides totais apresentou um resultado significativo igual a 20,4 ± 0,50 mg ER/g do extrato. No entanto, foi verificado baixo potencial antioxidante no extrato metanólico (CE50 foi de 280,90 ± 1,15 μg/mL). O ensaio para determinação de toxicidade sobre as larvas de A. salina evidenciou que o extrato metanólico foi moderadamente ativo com DL50 = 171,0 μg/mL. As classes metabólicas identificadas servirão como guia para futuro processo de isolamento e caracterização dos metabólitos supracitados. Os resultados obtidos revelaram-se promissores, incentivando o seguimento da investigação fitoquímica da espécie.
Agradecimentos
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de financiamento 001. Os autores também agradecem à UENF e à FAPERJ pelo apoio financeiro.
Referências
ARAÚJO, T. K. Avaliação in vitro do Potencial Antimicrobiano e da Atividade Antiproliferativa da Guapira Graciliflora Mart. (João-mole). Campina Grande. 2014. 77f. Dissertação (Mestrado em Odontologia) - Universidade Estadual da Paraíba, 2014.
BARBOSA, L. R. B. et al. Manual para análise fitoquímica e cromatográfica de extratos vegetais. Revista Científica da UFPA, v. 4, p. 1-19, 2004.
BARREIROS, A. L. B. S.; DAVID, J. M.; DAVID, J. P. Estresse oxidativo: relação entre geração de espécies reativas e defesa do organismo. Química Nova, v. 29, n. 1, p. 113-123, 2006.
BRASIL. Ministério do Meio Ambiente. Conselho Nacional do Meio Ambiente. Resolução CONAMA nº 417, de 23 nov. 2009. Dispõe sobre parâmetros básicos para definição de vegetação primária e dos estágios sucessionais secundários da vegetação de Restinga na Mata Atlântica e dá outras providências. Disponível em: http://www2.mma.gov.br/port/conama/legiabre.cfm?codlegi=617. Acesso em: 11 set. 2017.
CABRAL, D. L. V. Potencial antimicrobiano de plantas da caatinga utilizadas na medicina tradicional como anti-inflamatórias. Recife, 2014. 79f. Tese (Doutorado em Ciências Farmacêuticas) – Universidade Federal de Pernambuco, 2014.
CAO, G.; SOFIC, E.; PRIOR, R. L. Antioxidant and prooxidant behavior of flavonoids: structure-activity relationships. Free Radical Biology & Medicine, v. 22, n. 5, p. 749-760, 1997.
CASTILHO, R. O.; SOUZA, I. de; GUIMARAES, U. P. A survey of chemistry and biological activities of Chrysobalanaceae. Anais da Academia Brasileira de Ciência, v. 72, n.2, p. 292-293, jun. 2000.
CHAVES, T. P. Variação sazonal na produção de metabólitos secundários e na atividade antimicrobiana de espécies vegetais do semiárido brasileiro. Campina Grande, 2012. 78f. Dissertação (Mestrado em Tecnologia Ambiental) - Universidade Estadual da Paraíba, 2012.
DENNY, C. et al. Atividade antiproliferativa dos extratos e da fração orgânica obtidos das folhas de Virola sebifera Aubl. (Myristicaceae). Revista Brasileira de Farmacognosia, v.17, n.4, p. 598-603, out./dez. 2007.
FONSECA-KRUEL, V. S. et al. Plantas úteis da restinga: O saber dos pescadores artesanais de Arraial do Cabo, Rio de Janeiro. Rio de Janeiro: Instituto de Pesquisa Jardim Botânico do Rio de Janeiro, 2006.
FURLAN, A.; GIULIETTI, A. M. A tribo Pisonieae Meisner (Nyctaginaceae) no Brasil. Boletim de Botânica da USP, v. 32, n. 2, p. 145-268, 2014.
HAGERMAN, A. E.; BUTLER, L. G. Choosing appropriate methods and standards for assaying tannin. Journal of Chemical Ecology, v. 15, n. 6, p. 1795-1810, jun. 1989.
LUCENA, P. L. H. et al. Avaliação da ação da Aroeira (Schinus terebinthifolius Raddi) na cicatrização de feridas cirúrgicas em bexiga de ratos. Acta Cirúrgica Brasileira [online], v. 21, supl. 2, p. 46-51, 2006.
MARQUES, G. S. et al. Avaliação de procedimentos para quantificação espectrofotométrica de flavonoides totais em folhas de Bauhiniaforficata. Química Nova, v. 35, n.3, p. 517-522, 2012.
MENSOR, L. L. et al. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Química Nova, v. 15, n. 2, p. 127-130, mar. 2001.
MERCADANTE, M. Guapira pernambucensis. 2016. 1 fotografia, color., 27 cm x 27 cm. Disponível em: https://www.flickr.com/photos/mercadanteweb/31161762124. Acesso em: 6 dez. 2018.
MEYER, B. N. et al. Brine Shrimp a Convenient Genera Bioassay for Active Plant Constituents. Planta Medica, v. 45, n. 5, p. 31-40, maio 1982.
MOUCO, G.; BERNARDINO, M. J.; CORNÉLIO, M. L. Controle de Qualidade de Ervas Medicinais. Revista Biotecnologia Ciência & Desenvolvimento, n. 31, p. 68-73, jul./dez. 2003.
NACZK, M.; SHAHIDI, F. Review: Extraction and analysis of phenolics in food. Journal of Chromatography A, v. 1054, p. 95-111, out. 2004.
NGUTA, J. M. et al. Evaluation of acute toxicity of crude plant extracts from kenyan biodiversity using Brine Shrimp, Artemia salina L. (Artemiidae). The Open Conference Proceedings Journal, v. 3, Edição especial, p. 30-34, jun. 2012.
REYNERTSON, K. A; BASILE, M. J; KENNELLY, E. J. Antioxidant potential of seven myrtaceous fruits. Ethnobotany Research and Applications, v. 3, n. 1, p. 25-35, 2005.
RIO, R. G. W. Métodos de controle químico de amostras de própolis. 1996. 81p. Dissertação (Mestrado em Fármaco e Medicamentos) - Universidade de São Paulo, 1996.
SÁ, C. F. C. Nyctaginaceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro, 2015. Disponível em: http://reflora.jbrj.gov.br/jabot/FichaPublicaTaxonUC/FichaPublicaTaxonUC.do?id=FB10908. Acesso em: 12 set. 2018.
SANTOS, M. G. et al. Recursos vegetais da Restinga de Carapebus, Rio de Janeiro, Brasil. Revista de Biologia Neotropical, v. 6, n. 1, p. 35-54, 2009.
SANTOS, S. DA C.; MELLO, J. C. P. Taninos. In: SIMÕES, C. M. O. et al. (org.). Farmacognosia: da planta ao medicamento. 5. ed. Porto Alegre: Editora da UFSC/Editora da UFRGS, 2003.
SCHUMEDA-HIRSCHMANN, G. et al. Preliminary pharmacological studies on Eugenia uniflora leaves: Xanthine oxidase inhibitory activity. Journal of Ethnopharmacol., v. 21, n. 2, p. 183-186, nov. 1987.
SEVERI, J. A. Uso sustentável da biodiversidade brasileira: prospecção químico-farmacológica de plantas superiores: Guapira noxia (Nyctaginaceae). 2007. 144p. Dissertação (Mestrado em Ciências Farmacêuticas) - Universidade Estadual Paulista, 2007.
SILVA, N. L. A.; MIRANDA, F. A. A.; CONCEIÇÃO, G. M. Triagem fitoquímica de plantas de cerrado, da área de proteção ambiental municipal do Inhamum, Caxias, Maranhão. Scientia Plena, v. 6, n. 2, p. 1-17, 2010.
SIMÕES, C. M. O. et al. Farmacognosia: da planta ao medicamento. 3. ed. Florianópolis, SC: Editora da UFSC, 2001.
SIQUEIRA, M. J. et al. Estudo fitoquímico de Unonopsislindmanii - Annonaceae, biomonitorado pelo ensaio de toxicidade sobre a Artemia salina leach. Química Nova [online], v. 21, n. 5, p. 557-559, 1998. Disponível em: http://www.scielo.br/scielo.php?pid=S010040421998000500004&script=sci_abstract&tlng=es. Acesso em: 11 set. 2018.
SOUSA, C. M. M. et al. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quím. Nova [online], v. 30, n. 2, p. 351-355, mar./abr. 2007. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422007000200021. Acesso em: 11 set. 2018.
SOUZA, F. S. S.; JARDIM, J. G.; COELHO, A. A. O. P. Flora da Bahia: Guapira (Nyctaginaceae). Sitientibus série Ciências Biológicas, nov. 2016. Disponível em: https://www.researchgate.net/publication/310619240. Acesso em: 25 ago. 2018.
SOUZA, G. C. et al. Ethnopharmacological studies of antimicrobial remedies in the south of Brazil. Journal of Ethnopharmacology, v. 90, n. 1, p. 135-143, jan. 2004.
VAN ACKER, S. A. B. E. et al. Structural aspects of antioxidant activity of flavonoids. Free Radical Biology & Medicine, v. 20, n. 3, p. 331-342, 1996.
WU, N. et al. Antioxidant Activities of Extracts and Main Components of Pigeonpea [Cajanus cajan (L.) Millsp.] Leaves. Molecules, v. 14, p. 1032-1043, mar. 2009.
YUNES, R. S., CALIXTO, J. B. Plantas Medicinais sob a ótica da Química Medicinal Moderna. Joaçaba, SC: UNOESC, 2001.
Notas de autor
