ARTIGOS ORIGINAIS
Morfologia de frutos, sementes e plântulas, e aspectos de germinação de Adenanthera pavonina L. (Leguminosae)
Fruit, seed and seedling morphology and aspects of germination of Adenanthera pavonina L. (Leguminosae)
Morfología de frutos, semillas y plántulas, y aspectos de germinación de Adenanthera pavonina L. (Leguminosae)
Morfologia de frutos, sementes e plântulas, e aspectos de germinação de Adenanthera pavonina L. (Leguminosae)
Vértices (Campos dos Goitacazes), vol. 21, núm. 2, 2019
Instituto Federal de Educação, Ciência e Tecnologia Fluminense

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 17 Abril 2018
Aprobación: 15 Julio 2019
Resumo: Os objetivos deste trabalho foram descrever os aspectos morfológicos dos frutos, sementes e plântulas de Adenanthera pavonina L., além de verificar métodos alternativos para superação de dormência das sementes. Tais aspectos irão auxiliar nas formas de propagação desta espécie e também em sua identificação, ainda em estágio juvenil. Aspectos externos e internos dos frutos e sementes e externas de plântulas, além de medições biométricas foram realizados. Aplicaram-se tratamentos pré-germinativos para verificar o método mais eficiente. Com os resultados conclui-se que o fruto, tipo legume, apresenta em média de nove a dez sementes do tipo globosa e bitegumentada, com resquício de endosperma. O embrião é do tipo criptorradicular, sendo a germinação do tipo epígea, ocorrendo três dias após a semeadura, com formação completa da plântula aos vinte e dois dias. O método de escarificação mecânica com lixa foi o mais eficiente para superar a dormência de sementes de A. pavonina. Os aspectos descritos e ilustrados mostraram-se confiáveis para identificação da espécie e contribuem com informações úteis para o meio produtivo. Os testes alternativos à escarificação mecânica das sementes não foram eficientes para superação da dormência de A. pavonina.
Palavras-chave: Germinação, Morfologia, Taxonomia.
Abstract: This work aims to describe the morphological aspects of the fruits, seeds and seedlings of Adenanthera pavonina L., besides verifying alternative methods for overcoming seed dormancy. These aspects will help in methods of propagation of this species, and also in its identification, still in juvenile stage. External and internal aspects of fruits and seeds and external seedlings, besides biometric measurements were performed. Pre-germination treatments were applied to verify the most efficient method. With the results it is concluded that the fruit, a legume type, presents on average nine to ten seeds of the globose and double seed coat type, with endosperm remnant. The embryo is a crypto-radicular type, with germination of the epigeal type, occurring three days after sowing, with complete formation of the seedling at twenty-two days. The mechanical scarification with sandpaper method was the most efficient to overcome the A. pavonina seed dormancy. The described and illustrated aspects were reliable for identification of the species and contribute with useful information for the productive mean. The alternative tests to the mechanical scarification of the seeds were not efficient to overcome the dormancy of A. pavonina.
Keywords: Germination, Morphology, Taxonomy.
Resumen: Los objetivos de este trabajo fueron describir los aspectos morfológicos de los frutos, semillas y plántulas de Adenanthera pavonina L., además de verificar métodos alternativos para superar la latencia de las semillas. Estos aspectos ayudarán en las formas de propagación de esta especie, y también en la identificación de esta, aún en etapa juvenil. Se realizaron aspectos externos e internos de frutos y semillas y plántulas externas, además de mediciones biométricas. Se aplicaron tratamientos previos a la germinación para verificar el método más eficiente. Con los resultados se concluye que el fruto, de tipo leguminosa, presenta en promedio de nueve a diez semillas del tipo globoso y bitegumentado, con remanente de endospermo. El embrión es de tipo cripto-radicular, con germinación del tipo epigea, que ocurre tres días después de la siembra, con formación completa de la plántula a los veintidós días. El método de escarificación mecánica con papel de lija fue el más eficiente para superar las semillas de A. pavonina latentes. Los aspectos descritos e ilustrados fueron confiables para la identificación de las especies y contribuyen con información útil para el entorno productivo. Las pruebas alternativas a la escarificación mecánica de las semillas no fueron eficientes para superar la latencia de A. pavonina.
Palabras clave: Germinación, Morfología, Taxonomía.
1 Introdução
Fabaceae/Leguminoseae, família com distribuição geográfica em larga escala e caracterizada como a terceira maior família de angiospermas catalogadas (JUDD et al., 2009), tem como principal característica o fruto tipo legume (TALUKDAR, 2013). Esta família se subdivide em três subfamílias, sendo uma delas a Mimosoideae com cerca de 3270 espécies (LPWG, 2013).
Dentro da família Fabaceae encontra-se a espécie Adenanthera pavonina Linnaeus, vulgarmente conhecida como carolina, olho-de-dragão ou tento-carolina, originada da Índia e Malásia, porém no Brasil é encontrada em todo o litoral (KISSMANN et al., 2008). De acordo com os mesmos autores, sua madeira escura e compacta de boa qualidade é usada em marcenaria de luxo; uso ornamental, na arborização urbana, em reflorestamentos, artesanal e medicinal, sendo tanto sua madeira como suas sementes utilizadas como fitoterápicos. Na literatura, ainda são encontrados estudos verificando efeitos anti-inflamatórios e citoprotetores em macrógafos de ratos (KOODALINGAM et al., 2015), potencial controle de gorgulho-do-feijão (MACEDO et al., 2004), controle de larvas de Anagasta kuehniella (Zeller) (MACEDO et al., 2010) e potencial biotecnológico contra a broca da cana-de-açúcar (SILVA et al., 2012).
De acordo com Oliveira (2001), em função do grande número de espécies de Fabaceae/Leguminosae, ocorrem problemas taxonômicos e impasses filogenéticos, fazendo com que a análise tradicional de órgãos vegetativos e florais nessa família seja insuficiente, sendo necessário estudo de frutos, sementes, plântulas e plantas jovens, não somente com propósitos taxonômicos, filogenéticos ou ecológicos, mas também como contribuições ao conhecimento das espécies pertencentes a essa família.
Apesar de a A. pavonina Linnaeus pertencer à família Fabaceae e possuir muitos estudos de morfologia de suas espécies, na literatura existe uma carência de informações morfológicas de seus frutos, sementes e plântulas. O único trabalho encontrado na literatura que trata desse assunto é o dos autores Nielsen e Guinet de 1992, que estudaram o gênero Adenanthera.
A identificação de espécies através da morfologia dos frutos, sementes ou plântulas torna-se difícil quando estudos a seu respeito são escassos (PINTO et al., 2016). Muitas vezes, o estudo da estrutura, fenologia e do comportamento de uma espécie na sua comunidade é restrito, devido à falta da sua identidade, e em determinados casos, têm-se apenas o fruto, a semente ou a plântula para a sua identificação (SOARES et al., 2017). Ainda segundo Soares et al. (2017), a importância dos estudos morfológicos é decorrente, em grande parte, do fato de seu conhecimento servir como alicerce na identificação das espécies.
O conhecimento acerca da biomorfologia da germinação, do crescimento e estabelecimento de plântulas permite uma melhor compreensão do ciclo biológico de uma dada espécie e dos processos de estabelecimento desta em seu habitat (CAMARA et al., 2008), além de auxiliar em testes de germinação em laboratório, na produção de mudas em viveiro, na dinâmica das populações e em toda área de silvicultura (BRAZ et al., 2012).
Para muitas espécies florestais, as sementes não germinam, mesmo estando em condições favoráveis para germinação (GAMA et al., 2011). De acordo com Ribeiro et al. (2009), cerca de dois terços das espécies arbóreas apresentam certo grau de dormência, o que faz com que a verificação da dormência das sementes seja alvo de grande interesse dos pesquisadores, pois a maioria das espécies arbóreas é propagada por sementes (COELHO et al., 2010) e a dormência é um dos principais problemas para produção de mudas. Já se conhece que as sementes de A. pavonina apresentam dormência e, para Ribeiro et al. (2009) e Mantoan et al. (2012), os tratamentos mais indicados na superação de sua dormência são ácido sulfúrico e escarificação mecânica, porém são métodos pouco práticos para os produtores.
Diante do exposto, levando em consideração a importância econômica da espécie abordada, este trabalho teve como objetivos: descrever os aspectos morfológicos dos frutos, sementes e plântulas de A. pavonina, além de verificar métodos alternativos para superação de dormência das sementes.
2 Material e Métodos
2.1 Coleta de material botânico
Foram selecionados espécimes de A. pavonina em estágio de frutificação, localizadas no município de Cruz das Almas – BA. A região possui clima tropical quente e úmido (Am), segundo a classificação de Koppen, com altitude de 220 metros. Os frutos foram coletados de três espécimes diferentes nas coordenadas: 12° 39’ 37,9” S e 39° 5’ 18,6” W (espécime 1); 12° 39’ 27” S e 39° 5’ 11,9” W (espécime 2) e 12° 40’ 24,9” S e 39° 6’ 02” W (espécime 3), entre os meses de fevereiro e março de 2018.
Em seguida, todo o material foi encaminhado para o Laboratório de Análise de Sementes da Universidade Federal do Recôncavo da Bahia, situado no complexo da Engenharia Florestal.
2.2 Superação de dormência
As sementes foram desinfestadas com solução de hipoclorito de sódio a 0,5% por 30 segundos e lavadas com água destilada. O teste foi montado em papel germitest umedecido com 2,5 vezes seu peso seco (BRASIL, 2009a). Utilizou-se o germinador tipo BOD (Biochemical Oxigen Demand) na temperatura de 25 °C e fotoperíodo de 8 horas de luz e 16 horas de escuro.
Para a superação da dormência tegumentar foi montado um experimento em Delineamento Inteiramente Casualizado (DIC), com onze tratamentos composto por oito repetições, contendo 50 sementes em cada repetição (Tabela 1).

A primeira avaliação ocorreu dois dias após a montagem e as avaliações seguintes ocorreram a cada 7 dias, até completar 30 dias. As avaliações realizadas foram: Percentagem de Germinação e IVG (Índice de Velocidade de Germinação).
Os dados de percentagem de germinação e IVG foram transformados utilizando a transformação e a transformação Log, respectivamente. Para realização das análises foi utilizado o software R Versão 3.1.3. (R Core Development Team, 2015).
Os dados foram submetidos à análise de variância (ANOVA) e as médias comparadas pelo teste de Scott-Knott a 5% de probabilidade.
2.3 Morfologia de frutos
Para avaliações descritivas e estudos morfológicos foram examinados 100 frutos de cada matriz, escolhidos mediante uma amostragem aleatória, totalizando em 300 frutos para análise.
Os frutos foram avaliados quanto ao seu tipo, cor, comprimento, largura, espessura, textura e número de sementes sadias por fruto.
Considerou-se como comprimento do fruto a medida entre a sua base e o seu ápice. A largura foi obtida em três posições: distal, mediana e proximal. Para obtenção da espessura, mediu-se a região mediana da semente. O comprimento foi mensurado com régua milimetrada e a largura e espessura medida com um paquímetro digital de precisão 0,1 mm.
2.4 Morfologia das sementes
Nas avaliações das sementes, foram examinadas 100 sementes de cada matriz, escolhidos mediante uma amostragem aleatória, totalizando em 300 sementes para análise.
Na descrição das sementes foram avaliadas as seguintes variáveis: a) externas – cor, dimensões (comprimento, largura e espessura), peso de 1.000 sementes, textura, forma, hilo, calaza, tegumento; b) internas - tipo de embrião, forma, tamanho, localização e presença ou ausência de endosperma. Foram realizados cortes transversais e longitudinais com auxílio de lâminas para a avaliação das estruturas internas das sementes. Com a finalidade de assessorar os cortes e permitir uma melhor observação das características internas, escarificaram-se as sementes na extremidade oposta ao hilo com lixa n° 80 e posteriormente elas foram imersas em água destilada por 8 horas.
O peso de mil sementes foi obtido de oito subamostras de 100 sementes tomadas ao acaso, com valores expressos em gramas, conforme estabelecido na Regra de Análise de Sementes (BRASIL, 2009a).
O grau de umidade também foi determinado conforme o RAS pelo método da estufa a 105 °C 3 °C por 24 horas (BRASIL, 2009a), sendo o resultado expresso em porcentagem.
2.5 Germinação e morfologia das plântulas
Para a descrição morfológica das plântulas em diferentes estádios de desenvolvimento, foram semeadas, a cada dois dias, cinco sementes em bandejas de polietileno, encerrando a semeadura quando foi verificado que as plântulas oriundas das sementes semeadas no primeiro dia apresentaram o primeiro par de eófilos expandidos.
Antecedendo a semeadura, devido à dureza tegumentar e a impermeabilidade do tegumento a água, realizou-se o tratamento pré-germinativo de escarificação mecânica com lixa nº 80.
O substrato utilizado para o semeio foi o Vivato Plus, sendo realizadas irrigações diárias durante a condução do experimento. O desenvolvimento das plântulas ocorreu em casa de vegetação com sombrite 50%. No encerramento da semeadura, as plântulas foram retiradas do substrato apresentando todas as fases do desenvolvimento, que engloba desde a embebição da semente até a emissão do primeiro par de eófilos.
Foram descritas partes das plântulas, tais como: raiz primária e secundária, coleto, cotilédones, hipocótilo, epicótilo, tipo de germinação e primeiro par de eófilos. Também foi mensurado o comprimento da raiz primária, comprimento do hipocótilo e do epicótilo com régua milimetrada.
A terminologia e a metodologia utilizadas para o estudo morfológico basearam-se nos trabalhos de literatura de Barroso et al. (2004), Peske et al. (2006), BRASIL (2009a), BRASIL (2009b) e Vidal e Vidal (2013).
Os dados biométricos mensurados foram submetidos à análise descritiva, obtendo-se as respectivas médias, mínimo, máximo, coeficiente de variação e erro padrão da média. As ilustrações foram feitas manualmente, selecionando-se um material sadio bem desenvolvido e representativo de cada fase da formação da plântula.
3 Resultados e Discussão
3.1 Superação de dormência
Na Tabela 2 estão representados os dados de percentagem de germinação e Índice de Velocidade de Germinação (IVE). Dos tratamentos 2 ao 7 não houve diferença em relação à testemunha para as variáveis analisadas, em que as sementes permaneceram por diferentes tempos na estufa a uma temperatura de 70 °C e, em seguida, mantidas em água fria por 24 horas, não sendo métodos eficientes para superação da dormência das sementes dessa espécie.
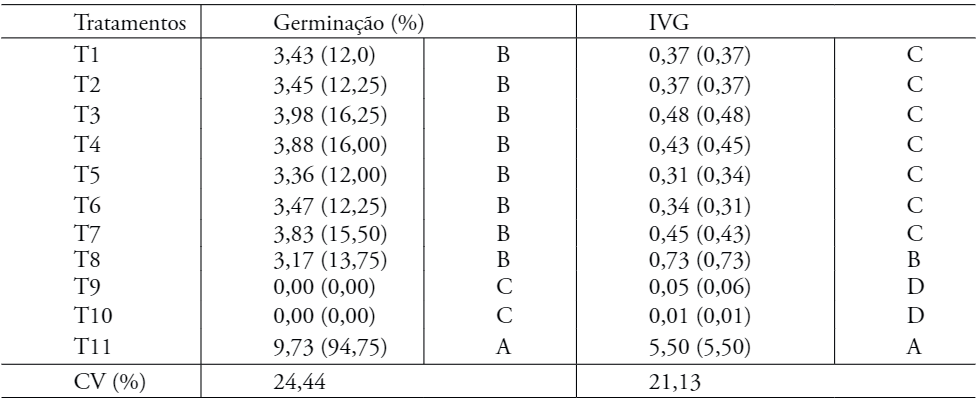
Médias seguidas pela mesma letra na coluna dentro de uma mesma variável, não difere entre si, pelo teste de Scott-Knott a 5% de probabilidade. CV: Coeficiente de Variação
Pode-se verificar que os tratamentos aplicados para superação da dormência das sementes de A. pavonina não promoveram efeitos positivos, com exceção do método mecânico com escarificação em lixa (Tratamento 11), o que para sementes de A. pavonina já é conhecido na literatura (RIBEIRO et al., 2009; MANTOAN et al., 2012). Nos tratamentos 9 e 10 verificou-se mortandade das sementes, como também verificado em Fonseca et al. (2013), em que o uso da água fervente inviabilizou a germinação de sementes de Plathymenia foliolosa, indicando que o tempo utilizado para manter as sementes em água fervente nesses dois tratamentos pode ter sido excessivo, já que a manutenção das sementes nessas condições por menor tempo permitiu que parte das sementes germinassem (T8).
Assim, torna-se necessário a verificação da eficiência desses métodos com tempos diferentes de permanência das sementes às condições aplicadas e também outros métodos que sejam mais eficientes para superação da dormência das sementes da A. pavonina, uma vez que a escarificação mecânica com lixa se torna inviável ao produtor quando eles precisam de uma grande quantidade de sementes.
3.2 Morfologia de frutos
O comprimento do fruto variou de 7,00 a 29,60 cm; a largura, na posição distal, de 8,70 a 16,77 mm, na posição mediana de 8,31 a 17,65 mm e na posição proximal de 7,6 a 17,47 mm; e a espessura variou de 2,46 a 12,00 mm (Tabela 3). No trabalho de Nogueira et al. (2010) também foram encontrados resultados semelhantes quanto à desuniformidade de tamanho quando eles estudaram a morfologia do fruto de pau-violeta (Dalbergia cearensis Ducke), com comprimento variando de 30,61 a 47,57 mm, largura entre 7,83 a 10,88 mm e espessura de 2,94 a 4,95 mm. Essa desuniformidade também pode estar ligada à variabilidade genética existente com maior intensidade em indivíduos arbóreos, pois a maioria destes ainda não passou pelo processo de domesticação e/ou melhoramento.
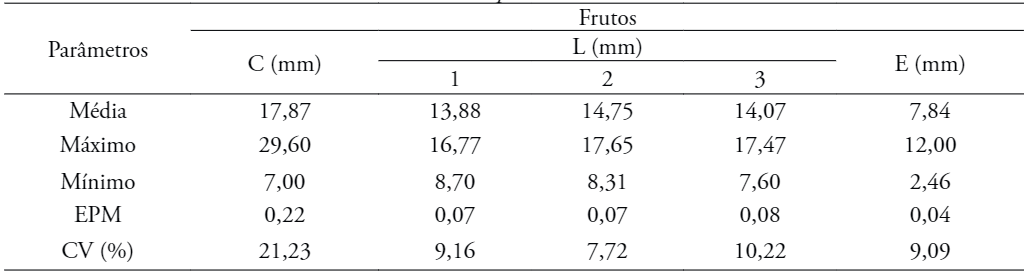
EMP: Erro Padrão da Média; CV: Coeficiente de Variação. C – comprimento; L – Largura; E – Espessura; 1 – distal; 2 – mediana; 3 - proximal
No trabalho realizado por Santos et al. (2014), verificou-se que o comprimento dos frutos apresentou uma média de 28,28 cm.
O número de sementes consideradas bem formadas por fruto variou de 1 a 13, sendo que a maioria dos frutos apresentou de 9 a 10 sementes (Figura 1), o que está bem próximo ao encontrado por Santos et al. (2014), que foi de 10,35 sementes por frutos para a mesma espécie. Porém, no estudo realizado por Nielsen e Guinet (1992) na região de origem da espécie, os autores verificaram que os frutos podem apresentar até 25 sementes por fruto.
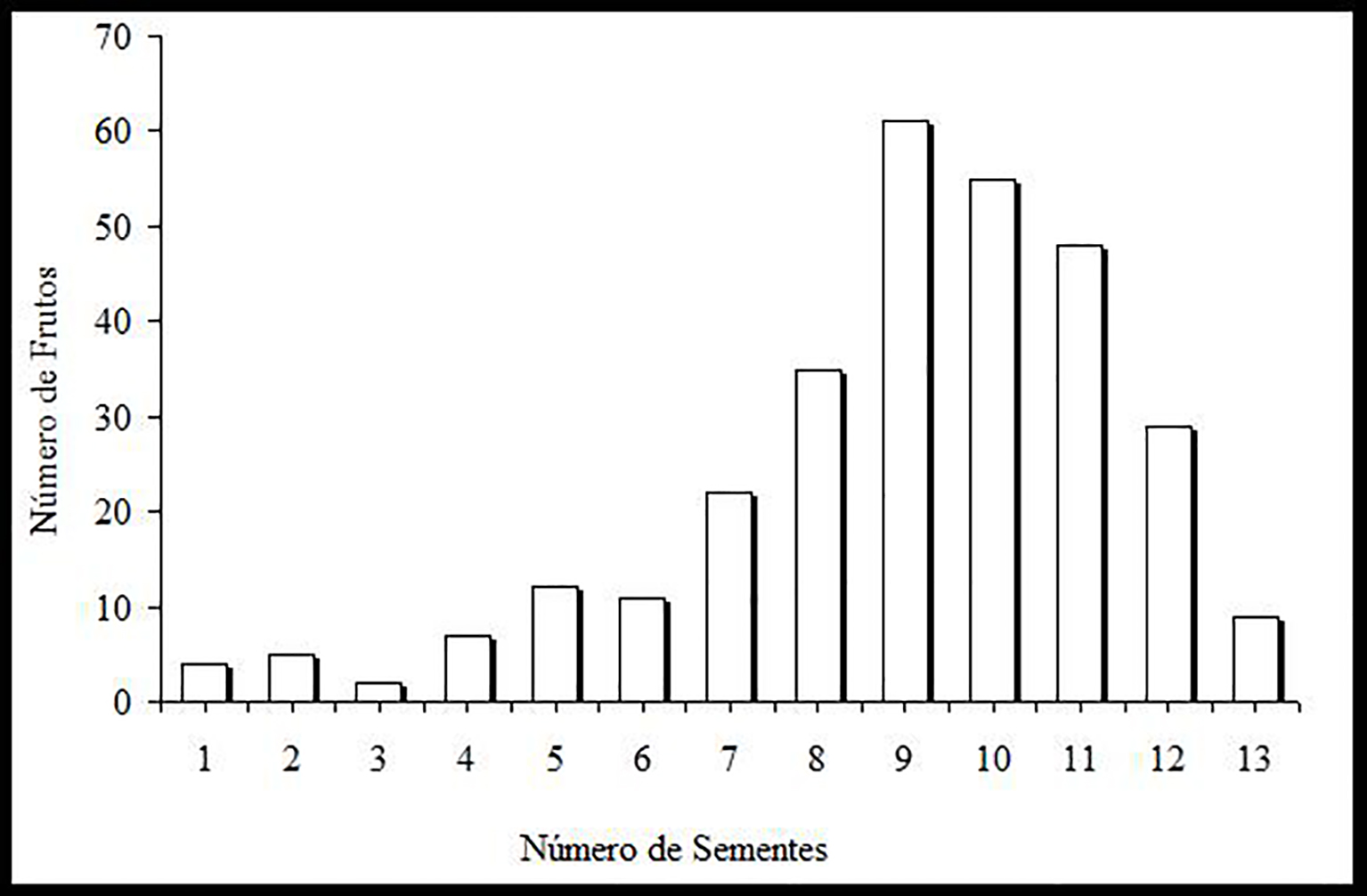
Figura 1.
Distribuição do número de sementes por fruto de A. pavonina
Outras espécies da família Fabaceae também apresentaram quantidade expressivas de sementes por fruto, assim como em A. pavonina, a exemplo de Clitoria fairchildiana R. A. Howard, que apresentou em média de 9,7 sementes por fruto (SILVA e MÔRO, 2008), de Mimosa caesalpiniifolia com uma média de 7,46 (FREITAS et al., 2013) e Acacia farnesiana (L.) Willd. (SILVA et al., 2014), com média de aproximadamente 17 sementes por fruto.
O fruto é do tipo legume, simples, seco, deiscente, polispérmico, de tamanho e formas variadas, cuja deiscência se dá no sentindo longitudinal, havendo sutura do pedúnculo até o ápice (Figura 2). Barroso et al. (2004) relatam que o fruto tipo legume é frequente em espécies da família Fabaceae, com grande diversidade morfológica, principalmente nas formas de deiscências, na ausência ou presença de septos, assim como no número de sementes, sendo tal variação podendo ser decorrente de uma consequente adaptação especial para a dispersão de suas sementes. De acordo com Nielsen e Guinet (1992), em todas as espécies, com exceção na A. abrosperma, aparecem duas fissuras longitudinais no epicarpo na sua deiscência, sendo que a área entre estas duas linhas são frequentemente ornamentadas por veias durante o processo de maturação das vagens.
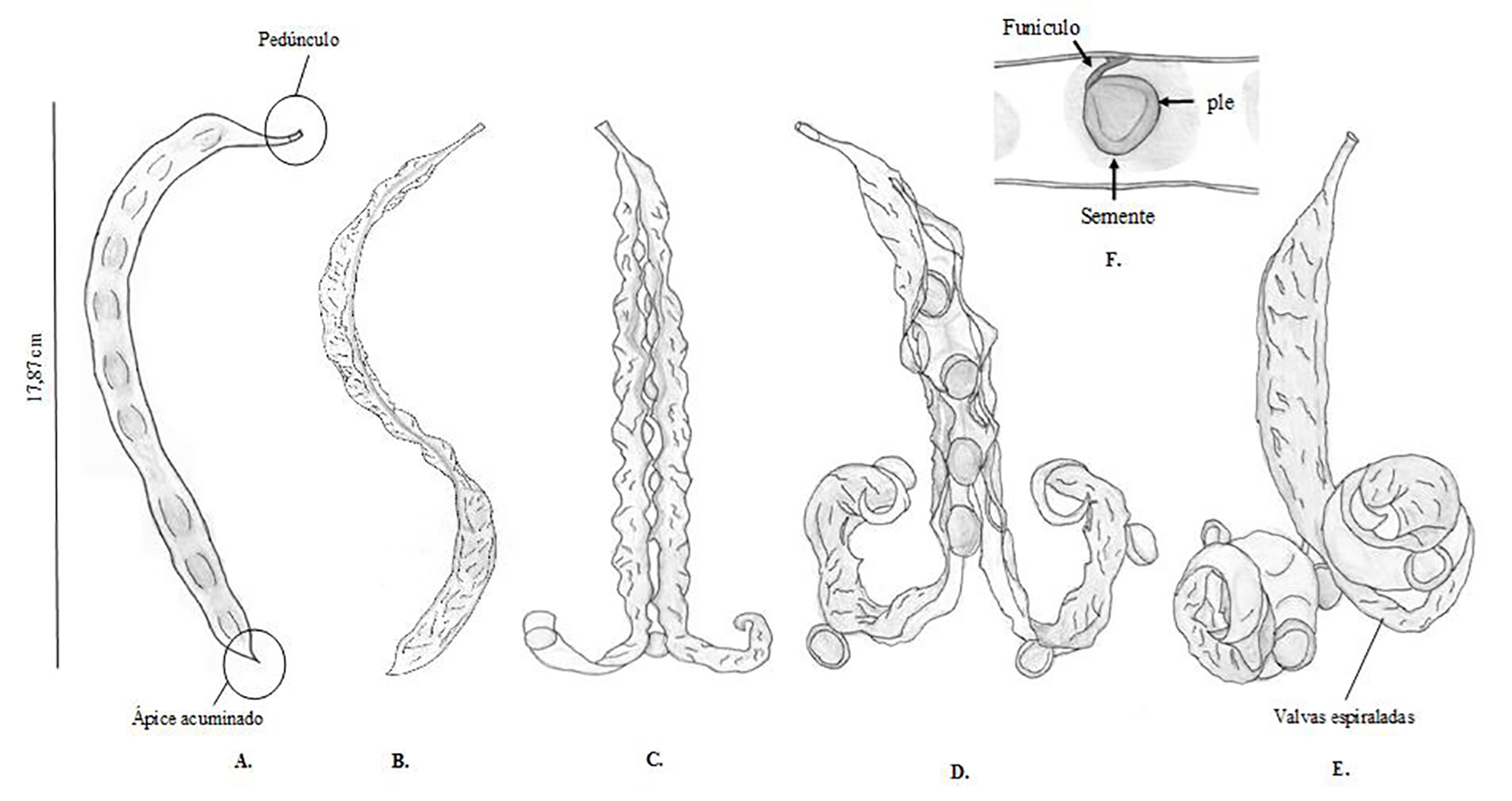
Figura 2.
Aspectos morfológicos de frutos de A. pavonina
Legendas: A – Fruto imaturo; B – Fruto maduro; C-D-E – Fruto após a deiscência com valvas espiraladas. F - Semente de A. pavonina ainda presa ao fruto por um funículo.
Em A. pavonina, após a deiscência as valvas se tornam espiraladas, deixando as sementes totalmente expostas (Figura 2E). Tal comportamento foi identificado para as espécies Poincianella gardneriana (Benth.) L. P. Queiroz, Chamaecrista amiciella (H. S. Irwin & Barneby), Chamaecrista duckeana (P. Bezerra & Afr. Fern.), Senegalia piauhiensis (Benth) Seigler & Ebinger e Pithecellobium diversifolium Benth, espécies pertencentes à mesma família (CÓRDULO, MORIM; ALVES, 2014).
Essa torção em espiral faz com que as sementes sejam lançadas a certa distância da planta mãe, caracterizando-se a dispersão do fruto como balística. O modo de dispersão balística é o que ocorre por meio de mecanismos ligados a abertura das valvas dos frutos que, ao se romperem, lançam as sementes para longe da planta mãe (FERREIRA; BORGHETTI, 2004).
Quando imaturo, o fruto apresenta o exocarpo com coloração verde. Quando maduro, apresenta coloração marrom enegrecida, com o pericarpo seco. A textura do pericarpo é áspera. O endocarpo apresenta coloração verde-clara a amarelada, as sementes se prendem aos frutos por funículos contorcidos (Figura 2F), como também observado por Barros e Morim (2014) em S. recurva, S. grandistipula e S. triacantha (Fabaceae) e por Ramos e Ferraz (2008) para Enterolobium schomburgkii Benth. (Leguminosae).
3.3 Morfologia das sementes
Em relação ao comprimento das sementes ocorreu uma variação de 7,51 a 9,50 mm, e em sua largura a variação foi de 7,74 a 10,40 mm com espessura variando de 4,82 a 8,41 mm (Tabela 4).
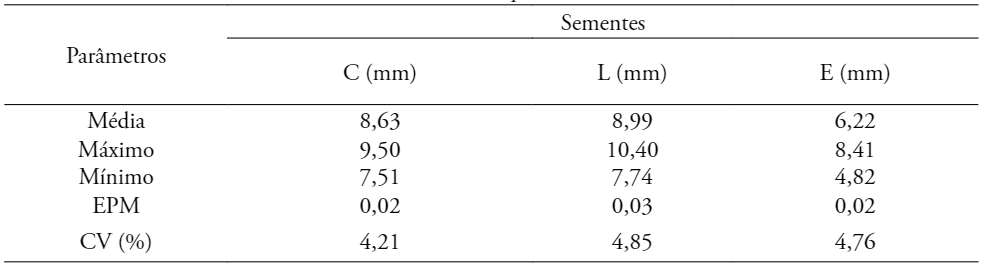
EMP: Erro Padrão da Média; CV: Coe+ ciente de Variação. C – comprimento; L – Largura; E - Espessura
O peso de 1.000 sementes de A. pavonina foi de 279,42 g, com coeficiente de variação de 0,7%, o que corresponde em um total de, aproximadamente, 3.578 sementes por quilo. No trabalho realizado por Siqueira-Silva et al. (2009) observou-se que o peso de mil sementes apresentou 304 g.
O grau de umidade foi de 10,8%. Souza et al. (2007), também trabalhando com sementes de A. panonina, colhidas em matrizes localizadas em região metropolitanna de Recife, verificaram teor de umidade semelhante ao encontrado neste trabalho (10%), por ocasião da instalação do experimento. Já no trabalho de Siqueira-Silva et al. (2009) o teor de umidade foi de 8,99% em sementes colhidas do campus Goiabeiras/UFES, município de Vitória/ES. Esses resultados indicam que as sementes de A. panonina podem ser classificadas como ortodoxas, o que, por definição, as caracteriza como sementes dispersas com teor de umidade bem reduzido (SIQUEIRA-SILVA et al., 2009).
As sementes de A. pavonina são pequenas, globosas, achatadas, duras, vermelho-brilhantes, bitegumentadas e albuminadas, apresentando formato orbicular com face convexa e testa rígido-membranácea (Figura 3). De acordo com Nielsen e Guinet (1992), a cor das sementes do gênero Adenanthera é de grande utilidade. Além da A. pavonina, apenas a A. microsperma e A. marina apresentam sementes monocromáticas; as demais espécies apresentam sementes dicrômicas, vermelhas e pretas. Os autores relatam ainda que a forma e o tamanho das sementes também podem ser muito úteis para distinguir as espécies do gênero Adenanthera. De acordo com os autores, a Adenanthera é o único gênero de Mimosoideae com sementes vermelhas e vagens oblongas lineares deiscentes.
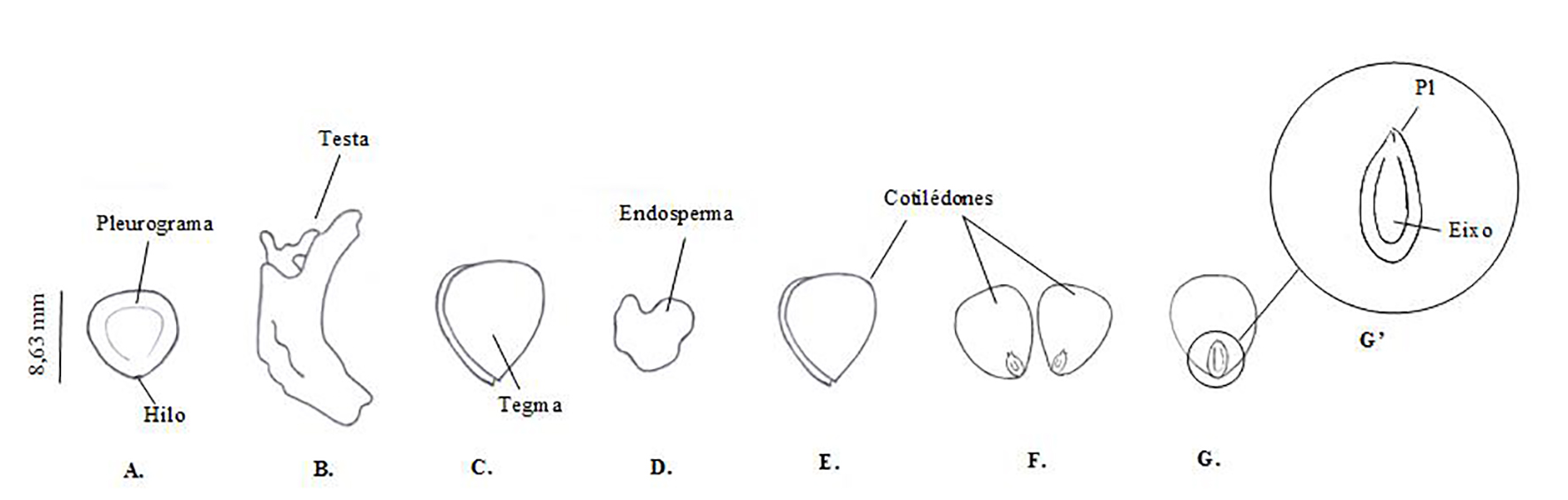
Figura 3.
Estrutura de uma semente de A. pavonina
Legenda: A - semente intacta; B - semente entumescida, com testa desprendendo da semente; C - testa; D - tegma; E - endosperma; F - cotilédone fechado; G - cotilédone aberto em corte longitudinal; H - metade de um cotilédone em corte longitudinal; H’ - ampliação do eixo embrionário. (Pl = plúmula; Eixo = eixo embrionário).
Quando imersa em água por pelo menos seis horas após escarificação mecânica com lixa, é possível observar a testa caracterizada por uma película muito fina e membranácea aderida ao tegma. O tegma apresenta cor laranja amarelada com consistência também membranácea, porém de maior espessura em relação à testa. Sementes bitegumentadas, isto é, com a presença de testa e tegma, também foram encontradas em Tapirira guianensis Aublet. (Anacardiaceae) (SANTANA et al., 2009); Tamarindus indica L. (Leguminosae) (SOUSA et al., 2010); Pachira aquatica Aubl. (Bombacaceae) (SILVA et al., 2012); e Poincianella pyramidalis (Tul.) L. P. Queiroz (Leguminosae) (MENDONÇA et al., 2016).
A semente de A. pavonina apresenta micrópila inconspícua se misturando ao hilo. O hilo é apical e pouco conspícuo, localizando-se na porção mediana em uma das extremidades, imediatamente contígua à ponta da radícula, de tamanho pequeno em relação à semente.
O embrião é criptorradicular, com cotilédones de oblongos a elípticos, plano-convexos, crassos, de superfície lisa, opostos, dispostos paralelamente ao curto eixo hipocótilo-radícula, os quais são amarelos elípticos e não diferem da cor do embrião e da plúmula rudimentar. No trabalho realizado por Córdula, Morim e Alves (2014) em uma área em Pernambuco avaliando a família Fabaceae, verificou-se que das espécies estudadas apenas as pertencentes à subfamília Mimosoideae apresentou o embrião do tipo criptorradicular.
Gunn (1984), em seu trabalho, relata a importância dos estudos da morfologia do eixo embrionário, principalmente da plúmula para auxiliar a identificação das sementes de Mimosoideae. Para a Mimosoideae, Oliveira (1999) propôs quatro tipos de plúmulas, dentre elas a plúmula rudimentar, que apresenta apenas um pequeno relevo acima da inserção dos cotilédones, como encontrado no presente trabalho.
Também notou-se nas sementes a presença de pleurograma paralelo à margem, com formato em “U” em ambas as faces, com abertura para a extremidade do hilo (Figura 4A). Essa estrutura é visível na maioria das sementes de Fabaceae (Mimosoidae), em forma de linha em “U” invertido, com abertura para a extremidade hilar (BRASIL, 2009b). Córdula, Morim e Alves (2014), estudando espécies da família Fabaceae, verificaram que a maioria das espécies (75%) avaliadas não apresentavam pleurograma, porém Nielsen e Guinet (1992), quando avaliaram o gênero Adenanthera, verificaram que todas as espécies analisadas apresentaram a estrutura com o mesmo formato.
Foi observada a presença de calaza, a qual é visível como uma faixa mais escura que circunda a semente. Internamente, o tecido de reserva que envolve o embrião, o endosperma, é transparente e com aspecto gelatinoso quando a semente está hidratada (Figura 4E). Geralmente, as sementes possuem endosperma duro e vítreo quando intactas e, quando hidratadas, o endosperma surge em aspecto gelatinoso, aumentando o seu volume (AMORIM et al., 2008). Em A. pavonina o endosperma não é abundante, apresentando somente o resquício.
Conforme Áquila (2004), todas as sementes são constituídas por endosperma no início do seu desenvolvimento, podendo no percurso este ser absorvido total ou parcialmente pelo embrião, restando apenas o resquício. Em casos em que o tecido endospermático é consumido parcialmente na formação do embrião, seu remanescente será utilizado no processo de germinação, na transformação do eixo embrionário em plântula (CARVALHO; NAKAGAWA, 2012).
3.4 Germinação e morfologia das plântulas
A germinação de A. pavonina é considerada como epígea fanerocotiledonar que, segundo Brasil (2009a), é a germinação na qual os cotilédones e a gema apical são elevados acima do solo em virtude do alongamento do hipocótilo. Segundo Soares et al. (2017), o padrão de desenvolvimento da plântula (fanerocotiledonar e epígea) parece estar relacionado com o estágio sucessional da espécie. Isto porque, conforme Ressel et al. (2004), plantas clímax tardias possuem sementes predominantemente hipógeo-armazenadoras, as quais possuem grande aptidão de proteção e armazenamento durante o processo germinativo, ao mesmo tempo que sementes de espécies pioneiras ou secundárias iniciais são geralmente epígeas fanerocotiledonar e resultam em plântulas como as de A. pavonina, com cotilédones expostos e fotossintetizantes, que assumem papel nutritivo para a plântula em desenvolvimento.
Os primeiros indícios de germinação surgem através do intumescimento da semente que aumenta de volume (Figura 4B). Devido à resistência e impermeabilidade tegumentar, as sementes sofreram uma escarificação para uma rápida absorção de água e posterior uniformização do desenvolvimento germinativo. Quando a germinação de A. pavonina é feita com sementes intactas, sem mecanismo de superação da dormência, a germinação ocorre de maneira desuniforme e lenta.
Com oito horas de embebição as sementes já se encontravam intumescidas, iniciando a emergência da radícula após três dias do início da semeadura, apresentando esta, formato cilíndrico, de coloração branca, rompendo o tegumento na região basal da semente, próxima a região do hilo (Figura 4B’).
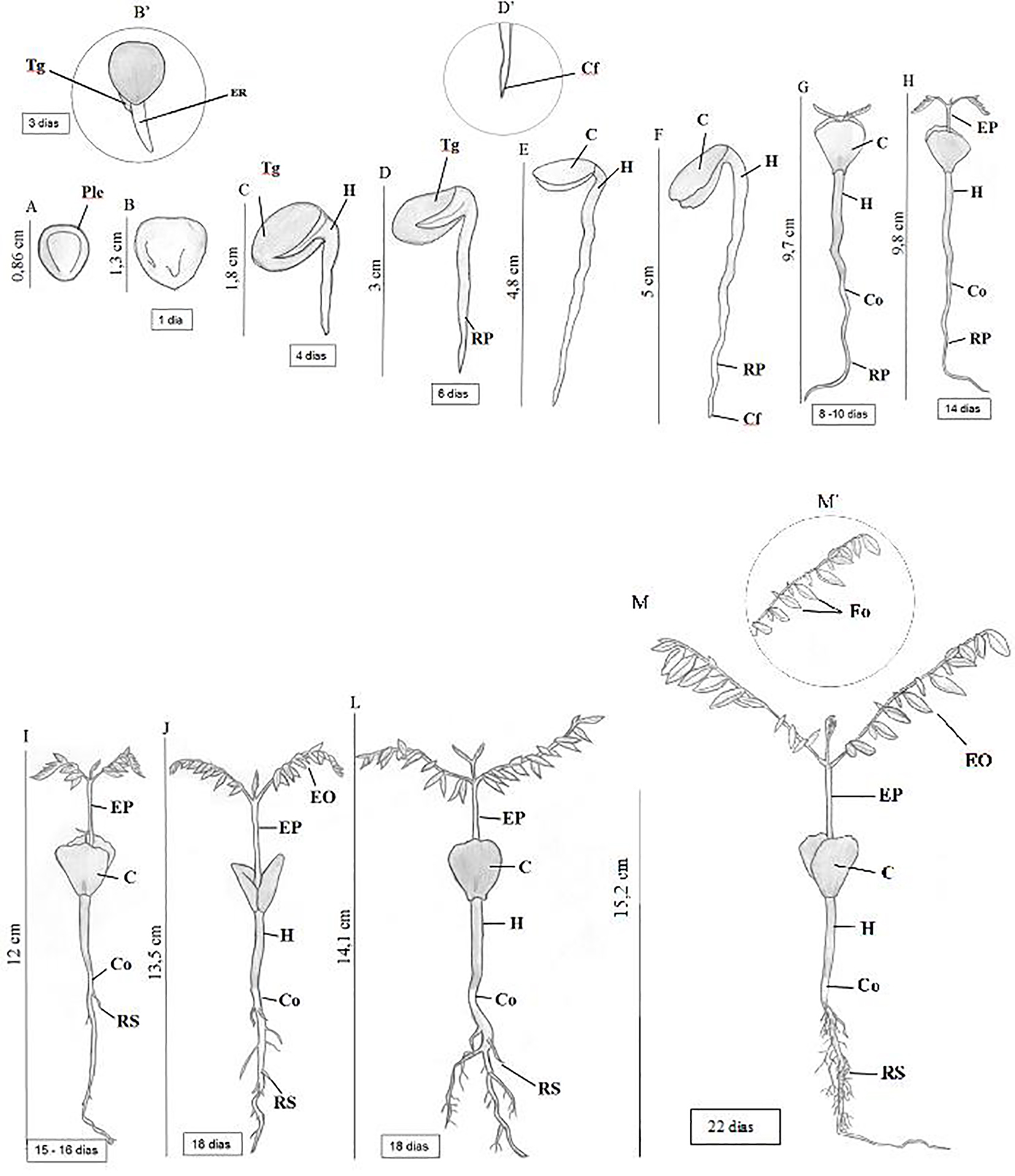
Figura 4.
Fases do desenvolvimento pós-seminal de Adenanthera pavonina
Legenda: A-M: desenvolvimento pós-seminal dos 12 aos 22 dias após a semeadura. Ple = pleurograma; Tg = tegumento; ER = emissão da radícula; Cf - coifa; H = hipocótilo; C = cotilédone; Co = Coleto; RP = raiz primária; EP = epicótilo; RS = raiz secundária; EO = eófilo; Fo = folíolo.
Assim como em A. pavonina, no trabalho realizado por Oliveira, Iwazaki e Oliveira (2014) com sementes de Mimosa daleiodes Benth., M. dolens Vell. var. anisitsii (Lindm.) Barneby e M. orthacantha Benth, também da família Fabaceae, apresentaram tegumento impermeável, resistente e de consistência córnea, fazendo-se necessária a escarificação para quebra da dureza tegumentar. De acordo com os autores, após o processo de escarificação, o tempo de protusão radicular primária dessas três espécies variou de 1 a 3 dias.
Uma leve dilatação da extremidade apical da radícula marca o aparecimento da coifa, que é cilíndrica, alongada, em cor inicialmente amarelada e posteriormente esbranquiçada, que termina numa ponta aguda (Figura 4D’).
O hipocótilo é curto, cilíndrico e levemente curvado, apresentando inicialmente coloração verde-clara a esbranquiçada e posteriormente um verde mais evidente. Pode ser notado no quarto dia após a germinação (Figura 4C). No oitavo dia após a semeadura, o hipocótilo apresenta-se com 1,4 cm de comprimento em média, alcançando até 2,7 cm com 18 dias. A emergência da plântula acima do solo tem início no sexto dia, com os cotilédones envoltos pelo tegumento que se desprende à medida que o par de cotilédones vai se abrindo (Figura 4D).
Aos oito dias após a semeadura, os cotilédones começam a expandir-se, completando sua expansão aos doze dias (Figura 4G). Inicialmente os cotilédones são amarelados, adquirindo posteriormente coloração verde, sendo opostos, glabros, carnosos, sésseis e com ápice obtuso, apresentando dimensões médias de 1,5 x 1,0 cm.
Observa-se o alongamento das raízes primárias no décimo segundo dia, apresentando de 3,7 a 5,5 cm de comprimento (Figura 4G). No décimo sexto dia, nota-se a formação dos primórdios das raízes secundárias, um pouco abaixo do coleto (Figura 4I). Aos 18 dias, a raiz primária lisa e curvada, de coloração marrom-claro, já exibia as raízes secundárias, finas, curtas e posteriormente alongadas, ramificadas e irregularmente distribuídas, de coloração semelhante à raiz primária, sendo então caracterizado o sistema radicular como axial (Figura 4J).
O coleto, a zona que separa a raiz do hipocótilo, apresenta-se um pouco dilatado podendo não ser tão nítido, entretanto difere-se da coloração da região, apresentando coloração esbranquiçada, reduzindo o diâmetro do hipocótilo (Figura 4H). O epicótilo tornou-se visível a partir do décimo quarto dia após a semeadura, com formato cilíndrico, reto e com tonalidade verde-clara (Figura 4H).
Aos 15 dias, surgiu o primeiro eófilo suboposto e imparipenado (Figura 4I). Aos 22 dias, a plântula, ainda com os cotilédones, apresentou o primeiro par de eófilos desenvolvidos, contendo cada um 10 pares de folíolos subopostos, elíticos, de coloração verde-clara, com presença de pecíolo, superfície lisa, base oblíqua, ápice agudo, margem inteira e apenas uma nervura visível (Figura 4M’). De acordo com Nielsen e Guinet (1992), algumas espécies do gênero Adenanthera geralmente apresentam as folhas terminais sempre alternadas como ocorre em A. pavonina, A. microsperma e A. marina, diferente do que ocorre nas A. malayana, A. borneensis . A. forbesii, porém os autores relatam que as semelhanças gerais na folha indicam que o grupo da Adenanthera é muito distinto na tribo Mimoseae.
Estudos morfológicos de plântulas em suas fases iniciais de desenvolvimento, antecedente a produção de folhas definitivas, possibilitam a visualização de estruturas transitórias ou primitivas, as quais tendem a desaparecer ao longo do desenvolvimento da plântula, que podem ser relevantes no estabelecimento de conexões filogenéticas com os grupos em que os órgãos adultos apresentem tais características (RICARDI et al., 1997). Montoro (2008) e Ferreira et al. (2001) também acrescentam que o acompanhamento na fase inicial de desenvolvimento da espécie permite a separação de espécies muito análogas, distinguindo os estádios juvenis da espécie, como também pode auxiliar em estudos de regeneração.
A formação total da plântula ocorreu aos 22 dias de germinação, considerando a presença de todas as estruturas necessárias ao seu desenvolvimento. Foram obtidos os comprimentos da raiz, que apresentou em média 6,0 cm; do hipocótilo em média com 3,0 cm; epicótilo, com média de 3,5 cm e o comprimento da plântula de 15,2 cm (Figura 4M).
De acordo com Nielsen e Guinet (1992), o conhecimento atual do gênero Adenanthera deixa várias perguntas ainda não respondidas. Os autores entendem que a morfologia das folhas e frutos são os caracteres diagnósticos mais importantes, uma vez que a morfologia das flores é de uso muito limitado.
A caracterização morfológica dos frutos, sementes e plântulas fornecem subsídios úteis para auxiliar o reconhecimento da espécie em laboratórios e banco de sementes, no conhecimento do ciclo biológico, da conservação e reprodução da espécie. Considerando em conjunto todas as características morfológicas da plântula descritas e o padrão de germinação da espécie, verifica-se que a A. pavonina apresenta características que favorecem à sua propagação e o seu estabelecimento, visto que em porcentagem elevada, a espécie se desenvolve de forma rápida.
4 Conclusão
O método de escarificação mecânica com lixa nº 120 foi o mais eficiente para superar a dormência de sementes de A. pavonina.
A germinação epígea ocorre aos três dias após a semeadura, com formação completa da plântula aos vinte e dois dias.
O fruto de A. pavonina é do tipo legume, contendo em média nove a dez sementes por fruto. As sementes são globosas e bitegumentadas, com superfície achatada e dura.
Embrião é do tipo criptorradicular, possui cotilédones dispostos paralelamente ao conciso eixo hipocótilo-radícula e apresenta resquício de endosperma.
Referências
AMORIM, I. L. et al. Morfologia de frutos, sementes, plântulas e mudas de Senna multijuga var. lindleyana (Gardner) H. S. Irwin & Barneby – Leguminosae Caesalpinioideae. Revista Brasileira de Botânica, v. 31, n. 3, p. 507-516, jul./set. 2008.
AQÜILA, M. E. A. Tipos de diásporos e suas origens. In: FERREIRA, A. G.; BORGHETTI, F. (org.). Germinação: do básico ao aplicado. Porto Alegre: ARTMED, 2004. p. 69-92.
BARROS, M. J. F.; MORIM, M. P. Senegalia (Leguminosae, Mimosoideae) from the Atlantic Domain, Brazil. The American Society of Plant Taxonomists. Systematic Botany, v. 39, n. 2, p. 452-477, jun. 2014.
BARROSO, G. M. et al.Frutos e Sementes. Edição: 1. Editora: Universidade Federal de Viçosa, 2004. 443p.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Regras para análise de sementes. Brasília, DF, 2009a. 395p.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Glossário ilustrado de morfologia. Brasília, 2009b. 406 p.
BRAZ, M. S. S. et al. Caracterização Morfológica do Fruto, Semente, Plântula e Planta Jovem e Germinação de Inga ingoides (Rich) Willd. Cerne, v. 18, n. 3, p. 353-360, jul./set. 2012.
CAMARA, C. A. et al. Caracterização morfométrica de frutos e sementes e efeito da temperatura na germinação de Parkia pendula (Willd.) Benth. Ex Walp. Ciência Florestal, v. 18, n. 3, p. 281-290, jul./set. 2008.
CARVALHO, N. M.; NAKAGAWA, J. Sementes: Ciência, Tecnologia e Produção. Jaboticabal, SP: Funesp, 2012. 590p.
COELHO, M. F. B. et al. Superação da dormência tegumentar em sementes de Caesalpinia ferrea Mart ex Tul. Revista Brasileira de Ciências Agrárias, v. 5, n. 1, p. 74-79, jan./mar. 2010.
CÓRDULA, E.; MORIN, M. P.; ALVES, M. Morfologia de frutos e sementes de Fabaceae ocorrentes em uma área prioritária para a conservação da Caatinga em Pernambuco, Brasil. Rodriguésia, v. 65, n. 2, p. 505-516, abr./jun. 2014.
FERREIRA, R. A et al. Morfologia de frutos, sementes, plântulas e plantas jovens de Dimorphandra mollis Benth.- faveira (Leguminosae- Caesalpinioideae). Revista Brasileira de Botânica, v.24, n.3, p.303-309, 2001.
FERREIRA, A. G.; BORGHETTI, F. Germinação: do básico ao aplicado. Porto Alegre, RS: Editora Artmed, 2004. 323p.
FONSECA, M. D. S. et al. Morfometria de sementes e plântulas e verificação da dormência da espécie Plathymenia foliolosa Benth. Comunicata Scientiae, v. 4, n. 4, p. 368-376, out./dez. 2013.
FREITAS, T. P. et al. Morfologia e caracterização da germinação em função da posição das sementes no fruto de sabiá. Scientia Plena, v. 9, n. 3, p. 1-9, mar. 2013.
GAMA, J. S. N. et al. Superação de dormência em sementes de Centrosema plumieri Benth. Revista Brasileira de Sementes, v. 33, n. 4, p. 643-651, 2011.
GUNN, C. R. Fruits and seeds of genera in the subfamily Mimosoideae (Fabaceae). Technical Bulletin, n. 1681, p. 1-194, Dec. 1984.
JUDD, W. S. et al. Sistemática vegetal: um enfoque filogenético. Tradução: André Olmos Simões. 3. ed. Porto Alegre: Artmed, 2009.
KISSMANN, C. et al. Tratamentos para quebra de dormência, temperaturas e substratos na germinação de Adenanthera pavonina L. Ciência Agrotécnica, v. 32, n. 2, p. 668-674, mar./abr. 2008.
KOODALINGAM, A. et al. Cytoprotective and anti-inflammatory effects ofkernel extract from Adenanthera pavonina on lipopolysaccharide-stimulated rat peritoneal macrophages. Asian Pacific journal of Tropical Medicine, v. 8, n. 2, p. 112-119, Feb. 2015.
LPWG [Legume Phylogeny Working Group]. Towards a new classification system for legumes: Progress report from in the International Legume Conference. South African Journal Botany, v. 89, p. 3-9, 2013.
MACEDO, M. L. et al. Kunitz-Type Inhibitor of Coleopteran Proteases, Isolated from Adenanthera pavonina L. Seeds and Its Effect on Callosobruchus maculatus. Journal of Agricultural and Food Chemistry, v. 52, n. 9, p. 2533−2540, May 2004.
MACEDO, M. L. et al. Adenanthera pavonina Trypsin inhibitor retard growth of Anagasta kuehniella (Lepidoptera: Pyralidae). Archives of insect biochemistry and physiology, v. 73, n. 4, p. 213-231, Apr. 2010.
MANTOAN, P. et al. Escarificação mecânica e química na superação de dormência de Adenanthera pavonina L. (Fabaceae: Mimosoideae). Scientia Plena, v. 8, n. 5, p. 1-8, maio 2012.
MENDONÇA, A. V. R. et al. Morfologia de frutos e sementes e germinação de Poincianella pyramidalis (Tul.) L. P. Queiroz, comb. Nov. Ciência Florestal, v. 26, n. 2, p. 375-387, abr./jun. 2016.
MONTORO, G. R. Morfologia de Plântulas de Espécies Lenhosas do Cerrado. 2008. 104 f. Dissertação (Mestrado em Botânica) - Instituto de Ciências Biológicas, Universidade de Brasília, Brasília, 2008.
NIELSEN, I.; GUINET, P. Synopsis of Adenanthera (Leguminosae-Mimosoideae). Nordic Journal of Botany, v. 12, n. 1, p. 85-114, 1992.
NOGUEIRA, F. C. B.; MEDEIROS FILHO, S.; GALLÃO, M. I. Caracterização da germinação e morfologia de frutos, sementes e plântulas de Dalbergia cearensis Ducke (pau violeta) - Fabaceae. Acta Botanica Brasilica, v. 24, n. 4, p. 978-985, out./dez. 2010.
OLIVEIRA, D. M. T. Morfo-anatomia do embrião de leguminosas arbóreas nativas. Revista Brasileira de Botânica, v. 22, n. 3, p. 413-427, dez. 1999.
OLIVEIRA, D. M. T. Morfologia comparada de plântulas e plantas jovens de leguminosas arbóreas nativas: espécies de Phaseoleae, Sophoreae, Swartzieae e Tephrosieae. Revista Brasileira de Botânica, v. 24, n. 1, p. 85-97, mar. 2001.
OLIVEIRA, J. H. G. de; IWAZAKI, M. C.; OLIVEIRA, D. M. T. Morfologia das plântulas, anatomia e venação dos cotilédones e eofilos de três espécies de Mimosa (Fabaceae, Mimosoideae).Rodriguésia, v. 65, n. 3, p. 777-789. 2014.
PESKE, S. T. et al. Sementes: fundamentos científicos e tecnológicos. Pelotas: Universitária/UFRel, 2006. 472p.
PINTO, M. B. et al. Caracterização morfológica de frutos, sementes, plântulas e germinação de Oreopanax fulvus Marchal. Agrária, v. 11, n. 2, p. 111-116, abr./jun. 2016.
RAMOS, M. B. P.; FERRAZ, I. D. K. Estudos morfológicos de frutos, sementes e plântulas de Enterolobium schomburgkii Benth. (Leguminosae-Mimosoideae).Revista Brasileira de Botânica, v. 31, n. 2, p. 227-235, abr./jun. 2008.
R DEVELOPMENT CORE TEAM. R: R Version 3.1.3 (2015-03-09). Viena: The R Foundation for Statistical Computing, 2015.
RESSEL, K. et al. Ecologia morfofuncional de plântulas de espécies arbóreas da Estação Ecológica do Panga, Uberlândia, Minas Gerais. Revista Brasileira de Botânica, v. 27, n. 2, p. 311-323, abr./jun. 2004.
RIBEIRO, V. V. et al. Tratamentos para superar a dormência de sementes de tento. Revista Biotemas, v. 22, n. 4, p. 25 – 32, dez. 2009.
RICARDI, M. et al. Morfologia de plântulas de arboles venezolanos. Revista Forestal Venezolana, v. 27, p. 15-56. 1977.
SANTANA, W. M. S. et al. Morfologia de flores, frutos e sementes de pau-pombo (Tapirira guianensis Aublet. - Anacardiaceae) na região de São Cristóvão, SE, Brasil. Scientia Florestalis, v. 37, n. 81, p. 047-054, mar. 2009.
SANTOS, I. S. et al. Biometria em Frutos e Sementes de Adenanthera pavonina L. In: SIMPÓSIO BRASILEIRO DE PÓS-GRADUAÇÃO EM CIÊNCIAS FLORESTAIS, 8., Pernambuco, PE, outubro 2014.
SILVA, B. M. S.; MÔRO, F. V. Aspectos morfológicos do fruto, da semente e desenvolvimento pós-seminal de faveira (Clitoria fairchildiana R. A. Howard. - Fabaceae). Revista Brasileira de Sementes, v. 30, n. 3, p. 195-201, 2008.
SILVA, K. B. et al. Morfometria de frutos e diásporos de Acacia farnesiana (L.) Willd. Revista Verde, v. 9, n. 2, p. 76-82, abr./jun. 2014.
SILVA, K. B. et al. Caracterização morfológica de frutos, sementes e fases da germinação de Pachira aquatica Aubl. (Bombacaceae). Semina: Ciências Agrárias, v. 33, n. 3, p. 891-898, maio/jun. 2012.
SIQUEIRA-SILVA, A. I. et al. Efeito da temperatura e de tratamentos pré-germinativos na germinação de sementes de Adenanthera pavonina L. Semina: Ciências Agrárias, v. 30, n. 4, p. 815-824, out./dez. 2009.
SOARES, I. D. et al. Caracterização morfológica de fruto, semente e plântula de Psidium rufum DC. (Myrtaceae). Iheringia, Série Botânica, v. 72, n. 2, p. 221-227, ago. 2017.
SOUSA, D. M. M. et al. Caracterização morfológica de frutos e sementes e desenvolvimento pós-seminal de Tamarindus indica L. Leguminosae: Caesalpinioideae. Revista Árvore, v. 34, n. 6, p. 1009-1015, nov./dez. 2010.
SOUZA, E. B. et al. Germinação de sementes de Adenanthera pavonina L. em função de diferentes temperaturas e substratos. Revista Árvore, v. 31, n. 3, p. 437-443, maio/jun. 2007.
TALUKDAR, D. Leguminosae. In: MALOY, S. R.; HAGHYS, K. (ed.). Brenner’s Encyclopedia of Genetics. 2nd. ed. Academic Press, 2013. p. 212-216.
VIDAL, W. N.; VIDAL, M. R. R. Botânica organografia: quadros sinóticos ilustrados de fanerógamos. 4. ed. Viçosa: Editora UFV, 2013. 124 p.
Notas de autor
