Artigos Originais
Avaliação da demanda de cloro para oxidação da cianobactéria Cylindrospermopsis raciborskii
Evaluation of chlorine demand for Cylindrospermopsis raciborskii cyanobacterium oxidation
Evaluación de la demanda de cloro para la oxidación de la cianobacteria Cylindrospermopsis raciborskii
Avaliação da demanda de cloro para oxidação da cianobactéria Cylindrospermopsis raciborskii
Vértices (Campos dos Goitacazes), vol. 22, núm. 1, 2020
Instituto Federal de Educação, Ciência e Tecnologia Fluminense

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 12 Septiembre 2019
Aprobación: 21 Marzo 2020
Resumo: O presente estudo teve como objetivo quantificar o cloro residual livre presente nas amostras e avaliar quais doses apresentam conformidade com o estabelecido pela Portaria da Consolidação. Para o desenvolvimento do estudo, utilizou-se a cianobactéria Cylindrospermopsis raciborskii, recorrente nas florações nos mananciais brasileiros. O oxidante escolhido foi o cloro gasoso, devido ao baixo custo e fácil manuseio. As análises foram feitas para as densidades 1,0 x 104 e 1,0 x 106 células.mL-1 e para os tempos de contato 30 min e 24 h. Os resultados obtidos demonstraram um elevado consumo de cloro e, consequentemente, baixa concentração de cloro residual livre.
Palavras-chave: Demanda de cloro, Cylindrospermopsis raciborskii, Cloro gasoso, Método colorimétrico.
Abstract: This study aimed to quantify the amount of free residual chlorine present in the samples and to evaluate which doses comply with the Consolidation Ordinance. To carry out the study, we used cyanobacterium Cylindrospermopsis raciborskii, recurrent in flowering in Brazilian springs. Chlorine gas was the oxidation selected due to its low-cost and easy handling. Analyses were performed at 1,0 x 104 and 1,0 x 106 cells.mL-1 and at 30 min and 24 h contact times. The results showed high chlorine consumption and, consequently, low concentration of free residual chlorine.
Keywords: Chlorine demand, Cylindrospermopsis raciborskii, Chlorine gas, Colorimetric method.
Resumen: El presente estudio tuvo como objetivo cuantificar el cloro residual libre presente en las muestras y evaluar qué dosis cumplen con la Ordenanza de consolidación. Para el desarrollo del estudio, utilizamos la cianobacteria Cylindrospermopsis raciborskii, recurrente en floración en manantiales brasileños. El oxidante elegido fue el cloro gaseoso, debido a su bajo costo y fácil manejo. Los análisis se realizaron a 1,0 x 104 y 1,0 x 106 células.mL-1 y en tiempos de contacto 30 min y 24 h. Los resultados mostraron un alto consumo de cloro y, en consecuencia, una baja concentración de cloro residual libre.
Palabras clave: Demanda de cloro, Cylindrospermopsis raciborskii, Cloro gaseoso, Método colorimétrico.
1 Introdução
O excesso de matéria orgânica e inorgânica presente na água, provenientes de descargas de esgoto doméstico, industrial ou de fertilizantes em áreas agrícolas, provoca a eutrofização do corpo hídrico, ou seja, o aumento do teor de nutrientes, e consequentemente a ocorrência de florações, ou bloom, de algas e, em alguns casos, cianobactérias tóxicas (NASCIMENTO, 2010), as quais, de acordo com Zamyadi et al. (2015), têm sido identificadas nas fontes de água potável e nas estações de tratamento de água (ETAs).
As cianobactérias são microrganismos procariontes, uni ou pluricelulares, aeróbios e fotoautotróficos encontrados em diferentes habitat. Por serem procariontes, assemelham-se bioquimicamente e estruturalmente às bactérias. Porém, também são similares às algas com relação às funções metabólicas e ao tamanho, por serem capazes de realizar fotossíntese (BRASIL, 2015; WHO, 2003; FUNASA, 2003).
Devido a características fisiológicas, como presença de vacúolos gasosos (confere mobilidade vertical, permitindo regular a profundidade da cianobactéria e otimizando as condições de luz e nutrientes em que se encontram), capacidade de fixação de nitrogênio (especialmente quando a relação nitrogênio-fósforo é baixa) e maior capacidade de acumulação de grânulos de polifosfato por parte de algumas espécies (permite a multiplicação das cianobactérias em situações de baixa concentração de fósforo), as cianobactérias conseguem se adaptar a sistemas eutrofizados e geralmente apresentam dominância (FERNANDES, 2008). O crescimento excessivo desses microrganismos promove maior custo e grandes complicações no tratamento de água para consumo humano, como, por exemplo, entupimento dos filtros devido à grande massa de cianobactéria, e a necessidade de outras etapas no tratamento para remover substâncias tóxicas (cianotoxinas) liberadas pelas mesmas, além de contribuírem para a formação de subprodutos da desinfecção, como trialometanos e ácidos haloacéticos, visto que a matéria orgânica presente na água é o principal precursor para a formação de tais substâncias (PEREIRA, 2005; PASCHOALATO, 2005; ROSARIO-ORTIZ; SNYDER, SUFFET, 2007; YANG; GUO; SHEN, 2011).
As cianotoxinas são metabólitos secundários com ações tóxicas produzidos pelas cianobactérias. Dentre esses metabólitos, as neurotoxinas e hepatotoxinas podem ser consideradas as principais, pois são danosas à saúde humana e aos animais, podendo ser fatais. Alguns gêneros de cianobactérias, como Microcystis, Cylindrospermopsis, Anabaena, Aphanizomenon e Planktothrix liberam tais toxinas através da lise celular (OLIVEIRA; MOLICA, 2003).
Cylindrospermopsis raciborskii (Woloszynska) Seenayya & Subba Raju 1972, são tricomas solitários, retos ou ligeiramente curvos; células cilíndricas, 2 a 3 μm de diâmetro, 7 a 11 μm de comprimento, com aerótopos; célula apical acuminada; heterocitos cônicos, terminais, 3-5 μm de diâmetro, 10-13 µm comprimento; acinetos cilíndricos, distantes dos heterocitos, 4-5 µm diâmetro, 13-16 µm comprimento (SANT’ANNA et al., 2007).
Apesar de a temperatura ser um dos principais fatores que influenciam no desenvolvimento da Cylindrospermopsis raciborskii, fazendo com que a espécie seja característica de climas tropicais e subtropicais, há relatos de sua presença em países de climas temperados como Áustria, França e Alemanha (BRIAND et al., 2004). De acordo com alguns autores, a primeira ocorrência da espécie em questão foi em 1969, no Lago do Paranoá, em Brasília (DF). Ainda, na década de 1990 ocorreu grande expansão na distribuição, que coincidiu com o aumento da eutrofização dos sistemas aquáticos em diversas regiões do Brasil (MELCHER, 2007; SANT’ANNA et al., 2008; ARAGÃO, 2011).
A espécie supracitada forma florações e apresenta elevada competitividade em ambientes eutrofizados, sendo uma das mais estudadas tanto na perspectiva da saúde pública, quanto da ecologia, devido à sua capacidade de produzir toxinas, como por exemplo cilindrospermopsina, que age no fígado e nos rins, e PSP (Paralytic Shellfish Poisons), que é paralisante e age no sistema nervoso (LAGOS et al., 1999; MASTEN, 2000; TUCCI; SANT’ANNA, 2003). De acordo com Oliveira e Molica (2003), o primeiro relato de intoxicação ocasionado pela Cylindrospermopsis raciborskii ocorreu na Austrália, em 1979, quando 141 apresentaram sintomas de hepatoenterite após consumirem água de um reservatório que havia sido submetido ao tratamento com algicida para eliminar uma floração.
No Brasil, para atender ao padrão de potabilidade estabelecido pela Portaria da Consolidação n° 5, de 28 de setembro de 2017, que dispõe a consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde, a água destinada ao consumo humano deve passar por processos de tratamento para adquirir características, determinadas pela portaria, que a classifiquem como potável. A desinfecção é um processo que tem por objetivo eliminar o risco da transmissão de doenças através da destruição ou inativação de microrganismos, principalmente os patogênicos, e pode ser realizado por meio de agentes físicos ou químicos. Há dois tipos de mecanismos que são predominantes no processo de desinfecção: a oxidação, seguida pela ruptura da parede celular, e a difusão no interior das células, que interfere na atividade celular dos microrganismos (MÉTODOS…, 2001).
O tipo de oxidante usado na etapa de desinfecção é escolhido considerando-se fatores como a quantidade necessária de reagente, facilidade de operação, custo e segurança (LEÃO, 2008). Apesar de a reação do cloro com a matéria orgânica ocasionar a formação de subprodutos indesejáveis, ele é o agente oxidante mais empregado nas ETAs devido à sua ação germicida, custo razoável, fácil acessibilidade e alta capacidade de oxidar matéria orgânica e inorgânica (FUNASA, 2014). Ainda, a quantidade de cloro a ser aplicada no tratamento da água deve ser suficiente para atender também as seguintes especificações do Anexo XX da Portaria da Consolidação: no mínimo, 0,2 mg.L-1 de cloro residual livre (CRL) ou 2 mg.L-1 de cloro residual combinado (CRC) ou de 0,2 mg.L-1 de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede).
Dado o exposto, torna-se importante o estudo da demanda de cloro da espécie Cylindrospermopsis raciborskii para se determinar quais doses de oxidante apresentam conformidade com o estabelecido pela Portaria da Consolidação.
2 Metodologia
De acordo com orientações de Jacinavicius et al. (2013), a cultura de Cylindrospermopsis raciborskii, obtida da Coleção de Algas e Cianobactérias do Laboratório de Ficologia ICB-UFMG (cepa 36) – isolada em Lagoa Santa/MG em dezembro de 2013, foi mantida nas seguintes condições: temperatura 24±2 °C, irradiância 40-50 µmol fótons m-2.s-1 e fotoperíodo 14-10 h claro-escuro, conduzidas em erlenmeyers replicados de 500 mL e 1 L, com cuidados para evitar qualquer tipo de contaminação externa. Ainda, conforme Jacinavicius et al. (2013), o meio de cultivo utilizado foi o ASM-1, e houve a necessidade de utilizar HCl (ácido clorídrico) 1M para acidificar o meio e NaOH (hidróxido de sódio) 1M para elevar o pH até que o mesmo fosse igual a 7,4. O meio de cultura concentrado foi armazenado no freezer, a 4 °C, até ser diluído para uso. Os repiques da espécie foram realizados conforme Camargo et al. (2018). Quando as amostras atingiam densidade próxima a 1,0 x 106 células.mL-1, repiques eram realizados com diluição de 1:10 para a renovação das culturas e 1:100 para obtenção da densidade 1,0 x 104 células.mL-1. Ambas densidades foram escolhidas para o estudo pois a primeira é usual em mananciais de abastecimento eutrofizados e a segunda é recorrente na etapa de clarificação nas ETAs, conforme revisão na literatura. Todas as análises foram feitas no Laboratório Multiusuário e o de Contaminantes do Instituto de Ciência e Tecnologia (ICET), pertencente à Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM), campus Mucuri, em Teófilo Otoni/MG.
2.1 Ensaios de cloração das células
O oxidante utilizado nas análises foi o cloro gasoso, o qual foi obtido na unidade COPASA em Teófilo Otoni/MG. A concentração real da solução de cloro gasoso foi determinada por titulação com tiossulfato de sódio, amido e iodeto de potássio. Após a determinação da concentração real (C1) de cloro em ambos os oxidantes, procederam-se aos cálculos para a concentração de cada dose (C2), obedecendo a equação C1.V1 = C2.V2. É importante ressaltar que a solução do cloro era usada imediatamente após o preparo para não haver perdas no processo, visto que é uma solução bastante volátil.
Para essa etapa, foram utilizados erlenmeyers (em triplicata) contendo 50 mL de amostra, e as seguintes dosagens de oxidante: 1,0; 1,5; 2,0; 2,5; 3,75; 5,0; 7,5 e 10,0 mg.L-1. Tais dosagens foram escolhidas visando uma maior variabilidade estatística e tendo como base as concentrações 2,5 e 5,0 mg.L-1, que são as mais usuais nas ETAs, pois apresentam um valor de residual em conformidade com o estabelecido pela portaria supracitada.
As concentrações residuais do cloro foram analisadas após 30 min de contato, referente aos primeiros minutos de formação, e após 24 h, que é referente à formação de CRL ao longo da rede de distribuição. A determinação da concentração de CRL foi efetuada por método colorimétrico com adição de N-dietil-parafenilendiamina (DPD), através de um comparador colorimétrico (HACH). No fluxograma a seguir apresenta-se de forma resumida o ensaio realizado (Figura 1).
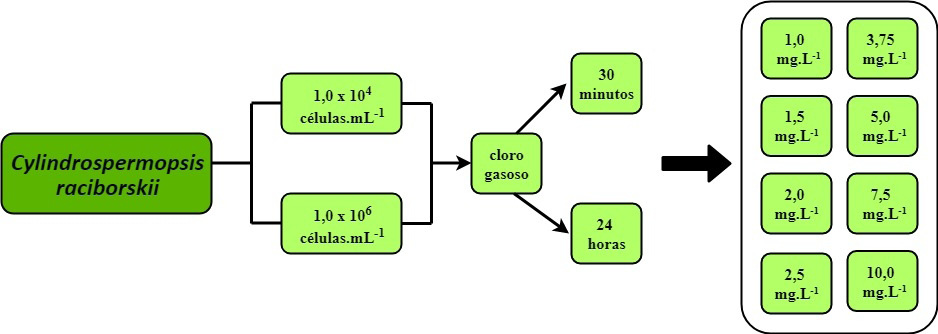
Figura 1.
Fluxograma do ensaio de cloração da espécie Cylindrospermopsis raciborskii
Fonte: Os autores
3 Resultados e discussões
As concentrações de CRL obtidas para as densidades 1,0 x 104 e 1,0 x 106 células.mL-1, tempos de contato 30 min e 24 h, e dosagens variando entre 1,0 e 10,0 mg.L-1, são apresentados nas Tabelas 1 a 4.
| Cylindrospermopsis raciborskii - 1,0 x 104 células. mL-1 | ||||||||||
| Tempo de contato | Ensaio | Dose de cloro gasoso | ||||||||
| 1,00 | 1,50 | 2,00 | 2,50 | 3,75 | 5,00 | 7,50 | 10,00 | |||
| mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | |||
| 30 minutos | 1 | Residual | 0,10 | 0,20 | 0,40 | 0,60 | 1,00 | 1,60 | 2,40 | 3,40 |
| Demanda | 0,90 | 1,30 | 1,60 | 1,90 | 2,75 | 3,40 | 5,10 | 6,60 | ||
| 2 | Residual | 0,10 | 0,20 | 0,40 | 0,60 | 1,20 | 1,70 | 3,40 | 3,40 | |
| Demanda | 0,90 | 1,30 | 1,60 | 1,90 | 2,55 | 3,30 | 4,10 | 6,60 | ||
| 3 | Residual | 0,10 | 0,20 | 0,20 | 0,60 | 1,20 | 1,80 | 2,60 | 3,40 | |
| Demanda | 0,90 | 1,30 | 1,80 | 1,90 | 2,55 | 3,20 | 4,90 | 6,60 | ||
| 4 | Residual | 0,10 | 0,10 | 0,20 | 0,60 | 0,70 | 1,40 | 2,10 | 3,20 | |
| Demanda | 0,90 | 1,40 | 1,80 | 1,90 | 3,05 | 3,60 | 5,40 | 6,80 | ||
| 5 | Residual | 0,10 | 0,10 | 0,10 | 0,60 | 0,70 | 1,50 | 2,30 | 3,30 | |
| Demanda | 0,90 | 1,40 | 1,90 | 1,90 | 3,05 | 3,50 | 5,20 | 6,70 | ||
| 6 | Residual | 0,10 | 0,10 | 0,40 | 0,60 | 1,00 | 1,50 | 2,30 | 3,40 | |
| Demanda | 0,90 | 1,40 | 1,60 | 1,90 | 2,75 | 3,50 | 5,20 | 6,60 | ||
| 7 | Residual | 0,10 | 0,10 | 0,40 | 0,60 | 0,80 | 1,20 | 3,40 | 3,40 | |
| Demanda | 0,90 | 1,40 | 1,60 | 1,90 | 2,95 | 3,80 | 4,10 | 6,60 | ||
| Média | Residual | 0,10 | 0,14 | 0,30 | 0,60 | 0,94 | 1,53 | 2,64 | 3,36 | |
| Demanda | 0,90 | 1,40 | 1,60 | 1,90 | 2,75 | 3,50 | 5,10 | 6,60 | ||
| Desvio Padrão | Residual | 0,00 | 0,05 | 0,12 | 0,00 | 0,20 | 0,18 | 0,50 | 0,07 | |
| Demanda | 0,00 | 0,05 | 0,12 | 0,00 | 0,20 | 0,18 | 0,50 | 0,07 | ||
| Cylindrospermopsis raciborskii - 1,0 x 104 células.mL-1 | |||||||||||
| Tempo de contato | Ensaio | Dose de cloro gasoso | |||||||||
| 1,00 | 1,50 | 2,00 | 2,50 | 3,75 | 5,00 | 7,50 | 10,00 | ||||
| mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | ||||
| 24 horas | 1 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 1,00 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,30 | 9,00 | |||
| 2 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,40 | 0,10 | 1,80 | 1,00 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,35 | 4,90 | 5,70 | 9,00 | |||
| 3 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,30 | 0,20 | 0,20 | 0,40 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,45 | 4,80 | 7,30 | 9,60 | |||
| 4 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,40 | 0,20 | 1,60 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,60 | 7,30 | 8,40 | |||
| 5 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,30 | 1,00 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,20 | 9,00 | |||
| 6 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,40 | 0,10 | 1,40 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,60 | 7,40 | 8,60 | |||
| 7 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,50 | 1,10 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,00 | 8,90 | |||
| Média | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,17 | 0,20 | 0,47 | 1,07 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,30 | 9,00 | |||
| Desvio Padrão | Residual | 0,00 | 0,00 | 0,00 | 0,00 | 0,12 | 0,13 | 0,55 | 0,35 | ||
| Demanda | 0,00 | 0,00 | 0,00 | 0,00 | 0,12 | 0,13 | 0,55 | 0,35 | |||
| Cylindrospermopsis raciborskii - 1,0 x 106 células.mL-1 | |||||||||||
| Tempo de contato | Ensaio | Dose de cloro gasoso | |||||||||
| 1,00 | 1,50 | 2,00 | 2,50 | 3,75 | 5,00 | 7,50 | 10,00 | ||||
| mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | ||||
| 30 minutos | 1 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,30 | 0,30 | 1,50 | 2,40 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,45 | 4,70 | 6,00 | 7,60 | |||
| 2 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,20 | 0,30 | 1,50 | 2,50 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,55 | 4,70 | 6,00 | 7,50 | |||
| 3 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,20 | 0,30 | 1,50 | 2,50 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,55 | 4,70 | 6,00 | 7,50 | |||
| 4 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,60 | 1,00 | 1,80 | 3,40 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,15 | 4,00 | 5,70 | 6,60 | |||
| 5 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,60 | 1,20 | 2,00 | 3,40 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,15 | 3,80 | 5,50 | 6,60 | |||
| 6 | Residual | 0,10 | 0,10 | 0,10 | 0,40 | 0,20 | 0,40 | 1,40 | 2,80 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,10 | 3,55 | 4,60 | 6,10 | 7,20 | |||
| 7 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 0,40 | 1,60 | 2,80 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,55 | 4,60 | 5,90 | 7,20 | |||
| Média | Residual | 0,10 | 0,10 | 0,10 | 0,21 | 0,33 | 0,56 | 1,61 | 2,83 | ||
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,55 | 4,60 | 6,00 | 7,20 | |||
| Desvio Padrão | Residual | 0,00 | 0,00 | 0,00 | 0,08 | 0,17 | 0,35 | 0,20 | 0,39 | ||
| Demanda | 0,00 | 0,00 | 0,00 | 0,08 | 0,17 | 0,35 | 0,20 | 0,39 | |||
| Cylindrospermopsis raciborskii - 1,0 x 106 células.mL-1 | ||||||||||
| Tempo de contato | Ensaio | Dose de cloro gasoso | ||||||||
| 1,00 | 1,50 | 2,00 | 2,50 | 3,75 | 5,00 | 7,50 | 10,00 | |||
| mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | mg.L-1 | |||
| 24 horas | 1 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 0,40 |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,30 | 9,60 | ||
| 2 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 0,50 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,30 | 9,50 | ||
| 3 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 0,20 | 0,80 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,80 | 7,30 | 9,20 | ||
| 4 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,40 | 0,80 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,10 | 9,20 | ||
| 5 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,20 | 0,20 | 0,40 | 0,80 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,55 | 4,80 | 7,10 | 9,20 | ||
| 6 | Residual | 0,10 | 0,10 | 0,10 | 0,20 | 0,10 | 0,10 | 0,40 | 0,80 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,30 | 3,65 | 4,90 | 7,10 | 9,20 | ||
| 7 | Residual | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,10 | 0,40 | 0,80 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,10 | 9,20 | ||
| Média | Residual | 0,10 | 0,10 | 0,10 | 0,11 | 0,11 | 0,13 | 0,31 | 0,70 | |
| Demanda | 0,90 | 1,40 | 1,90 | 2,40 | 3,65 | 4,90 | 7,10 | 9,20 | ||
| Desvio Padrão | Residual | 0,00 | 0,00 | 0,00 | 0,03 | 0,03 | 0,05 | 0,10 | 0,16 | |
| Demanda | 0,00 | 0,00 | 0,00 | 0,03 | 0,03 | 0,05 | 0,10 | 0,16 | ||
De acordo com os resultados apresentados nas Tabelas 1 e 3, pode-se afirmar que para 30 min de contato, aproximadamente, 54% e 48% das amostras apresentaram valores de CRL entre 0,2 e 2,0 mg.L-1 para as densidades 1,0 x 104 e 1,0 x 106células.mL-1, respectivamente, ou seja, estavam em conformidade com a Portaria da Consolidação. Já para 24 h de contato, cerca de 32% das amostras para ambas densidades analisadas apresentaram valor de CRL conforme o preconizado pela portaria em questão.
O elevado consumo de cloro observado neste estudo pode ser explicado pela oxidação de compostos intracelulares e cianotoxinas possivelmente liberadas pela espécie de estudo, pois, de acordo com Oliveira e Molica (2003), o gênero Cylindrospermopsis forma florações onde há a liberação de toxina através da lise celular. Ainda, foi comprovado que as cepas brasileiras de Cylindrospermopsis raciborskii produzem saxitoxinas devido à presença, no genoma da espécie, do gene que codifica a biossíntese desse tipo de toxina (ABREU et al., 2018).
O estudo de Freitas (2007), o qual apresenta resultados da demanda de cloro exercida pelas saxitoxinas e os compostos extracelulares da Cylindrospermopsis raciborskii, mostra que, para doses de cloro na faixa de 0,5 mg.L-1, 1,0 mg.L-1, 2,0 mg.L-1, 4,0 mg.L-1 e 8,0 mg.L-1 e tempos de contato de 10 e 30 minutos, o cloro foi completamente consumido no processo de oxidação das saxitoxinas. Neste contexto, o elevado consumo de cloro observado no presente estudo pode ser justificado provavelmente pela oxidação de cianotoxinas do tipo saxitoxinas, liberadas através da lise celular.
Viana (2006) utilizou em seu estudo o oxidante hipoclorito de cálcio para remoção das saxitoxinas e tempos de contato de 30 e 60 minutos. Os resultados obtidos pela autora mostram que a oxidação química da toxina gerou residual de saxitoxina praticamente abaixo de 3 µg.L-1, logo uma remoção bastante elevada, acima de 80%, o que representa um elevado consumo de oxidante. Esse consumo significativo de oxidante também foi observado no presente estudo, podendo, portanto, ser explicado pela provável presença e oxidação de saxitoxina nas amostras analisadas.
Lin et al. (2017) utilizaram em seu estudo os oxidantes hipoclorito de sódio e dióxido de cloro e a espécie de cianobactéria Cylindrospermopsis raciborskii. De acordo com os autores, a pré-oxidação da amostra resultou em uma redução significativa do número de células de aproximadamente 88.000 células.mL-1 para 36.250 células.mL-1. Ainda, as células de cianobactéria foram divididas em fragmentos, acompanhados pela liberação de matéria orgânica intracelular. A diminuição na concentração de células e a maior presença de matéria orgânica intracelular nas amostras podem justificar um maior consumo de oxidante, o que também foi observado nos resultados obtidos neste estudo, em que todas as amostras apresentaram mais de 50% de consumo de oxidante.
De acordo com os resultados obtidos por Zamyadi et al. (2012), que utilizaram a mesma espécie de cianobactéria em seu estudo, baixas doses de oxidante podem ocasionar rápida liberação de toxinas e subsequente oxidação das mesmas, promovendo o consumo do cloro. Os autores observaram ainda, através de modelagens matemáticas, que a oxidação dessas toxinas (total ou dissolvida) acontece de maneira mais rápida que a lise das células, sugerindo que as toxinas liberadas pelas células reajam mais rapidamente com o cloro que o restante das células danificadas ou outras substâncias dissolvidas. Tal cenário pode justificar o elevado consumo de oxidante observado neste estudo. Ainda, de acordo com os autores, além da liberação de toxina, a oxidação do cloro promoveu a perda da integridade das células, o que pode explicar a presença de filamentos imóveis e menores que o tamanho real nas amostras cloradas neste estudo.
4 Conclusões
A quantificação e análise dos valores obtidos de cloro residual livre através do método colorimétrico (HACH) foram possíveis. O elevado consumo de cloro gasoso pode ser explicado pela oxidação das células de Cylindrospermopsis raciborskii e da matéria orgânica intracelular liberada por elas. Com base nos resultados apresentados, cerca de 38% das amostras analisadas apresentaram valores de cloro residual livre entre 0,2 e 2 mg.L-1 e, portanto, estavam em conformidade com o estabelecido pela Portaria da Consolidação.
Agradecimentos
Os autores agradecem à CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico - Brasil) as bolsas de iniciação científica vinculadas à pesquisa; à Fundação Nacional de Saúde (FUNASA) o apoio financeiro e à Universidade Federal dos Vales do Jequitinhonha e Mucuri por todo o suporte físico e laboratorial.
Referências
ABREU, V. A. C. et al. Genomic and Genotypic Characterization of Cylindrospermopsisraciborskii: Toward an Intraspecific Phylogenetic Evaluation by Comparative Genomics. Frontiers in Microbiology, v. 9, 2018.
ARAGÃO, N. K. C. V. Taxonomia, distribuição e quantificação de populações de cianobactérias em reservatórios do estado de Pernambuco (Nordeste do Brasil). 2011. 159 f. Dissertação (Mestrado em Botânica) – Universidade Federal Rural de Pernambuco, Departamento de Biologia, Recife, 2011.
BRASIL. Ministério da Saúde. Cianobactérias/Cianotoxinas: procedimentos de coleta, preservação e análise. Brasília, 2015. 106 p.
BRASIL. Ministério da Saúde. Portaria de Consolidação n. 5, de 28 de setembro de 2017. Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde. Diário Oficial da União, Brasília, 3 out. 2017. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/gm/2017/prc0005_03_10_2017.html. Acesso em: 9 maio 2018.
BRIAND, J. F. et al. Cylindrospermopsis raciborskii (Cyanobacteria) invasion at mid-latitudes: selection, wide physiological tolerance or global warming. Journal of Phycology, v. 40, n. 2, p. 231-238, 2004.
CAMARGO, J. A. et al. Análise do consumo de cloro para oxidação da espécie de cianobactéria Microcystis aeruginosa. Vértices, Campos dos Goytacazes, v. 20, n. 2, p. 213-223, maio/ago. 2018.
FERNANDES, S. S. Biodisponibilidade de Cianotoxinas em Bivalves. 2008. 51 f. Dissertação (Mestrado em Ecologia Aplicada) – Faculdade de Ciências, Departamento de Zoologia-Antropologia, Universidade de Porto, 2008.
FRANCO, E. S. Avaliação da formação de trialometanos e ácidos haloacéticos decorrentes da cloração de águas de abastecimento contendo cianobactérias. 2018. 244 f. Tese (Doutorado em Saneamento, Meio Ambiente e Recursos Hídricos) – Universidade Federal de Minas Gerais, Escola de Engenharia, Belo Horizonte, 2018.
FREITAS, M. S. Remoção de microcistinas e saxitoxina por meio de oxidação com hipoclorito de sódio: Avaliação em escala de bancada. 120 f. Dissertação (Mestrado em Tecnologia Ambiental e Recursos Hídricos) – Universidade de Brasília, Brasília, 2007.
FUNDAÇÃO NACIONAL DE SAÚDE. FUNASA. Cianobactérias tóxicas na água para consumo humano na saúde pública e processos de remoção em água para consumo humano. Brasília, 2003. 56 p.
FUNDAÇÃO NACIONAL DE SAÚDE. FUNASA. Manual de Cloração de Água em Pequenas Comunidades: Utilizando o Clorador Simplificado Desenvolvido pela Funasa. Brasília, 2014. 45 p.
JACINAVICIUS, F. R. et al. Manual para Cultivo de Cianobactérias. São Paulo: Secretaria do Meio Ambiente do Estado de São Paulo, Instituto de Botânica, Núcleo de Pesquisa em Ficologia, 2013. 32 p.
LAGOS, N. et al. The first evidence of paralytic shellfish toxins in the freshwater cyanobacterium Cylindrospermopsis raciborskii, isolated from Brazil. Toxicon, n. 37, p. 1359-1373, 1999.
LEÃO, V. G. Água Tratada: Formação de Trialometanos pelo uso de cloro e os riscos potenciais à saúde pública em cidades da mesorregião do leste rondoniense. 131 f. Dissertação (Mestrado em Ciências da Saúde) – Universidade de Brasília, Brasília, 2008.
LI, H. et al. Behavior of Cylindrospermopsisraciborskii during coagulation and sludge storage – higher potential risk of toxin release than Microcystis aeruginosa?.Journal of Hazardous Materials, v. 347, p. 307-316, 2018.
LIN, L. et al. Algal removal from cyanobacteria-rich waters by preoxidation-assisted coagulation-flotation: Effect of algogenic organic matter release on algal removal and trihalomethane formation. Journal of Environmental Sciences, v. 63, p. 147-155, 2017.
MASTEN, S. Cylindrospermopsin: Review of toxicological literature. North Carolina, USA: National Institute of Environmental Health Sciences, 2000. 49 p.
MELCHER, P. S. Estudos morfológicos e de cianobácterias potencialmente tóxicas dos gêneros Cylindrospermopsis, aphanizomenon e raphidiopsis (Nostocales). 2007. 204 f. Tese (Doutorado em Biodiversidade Vegetal e Meio Ambiente) – Instituto de Botânica da Secretaria do Meio Ambiente do Estado de São Paulo, São Paulo, 2007.
MÉTODOS alternativos de desinfecção da água. Programa de Pesquisas em Saneamento Básico. PROSAB. 1. ed. São Carlos: Rima Artes e Textos, 2001. 149 p.
MORAIS, A. S. Avaliação de técnicas convencionais de tratamento de água para consumo humano na remoção de cianobactérias e cianotoxinas e processos oxidativos para remoção de microcistinas. 2012. 159 f. Tese (Doutorado em Engenharia Civil) – Universidade Federal de Viçosa, Viçosa, 2012.
NASCIMENTO, P. B. Cianobactérias como indicadoras de poluição nos mananciais abastecedores do Sistema Cantareira. 2010. 116 f. Dissertação (Mestrado em Saúde Pública) – Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo, 2010.
OLIVEIRA M. C. B.; MOLICA R. Cianobactéria invasora: aspectos moleculares e toxicológicos de Cylindrospermopsis raciborskii no Brasil. Revista Biotecnologia, Ciência e Desenvolvimento, v. 30, p. 82-90, 2003.
PADISÁK, J. Cylindrospermopsis raciborskii (Woloszynska) Seenayya et Subba Raju, an expanding, highly adaptative cyanobacterium: worldwide distribution and review of its ecology. Archives für Hydrobiologie, v. 4, p. 563-593, 1997.
PASCHOALATO, C. F. P. R. Efeito da pré-oxidação, coagulação, filtração e pós-cloração na formação de subprodutos orgânicos halogenados em águas contendo substâncias húmicas. 2005. 291f. Tese (Doutorado em Engenharia Civil, área de concentração em Hidráulica e Saneamento) – Universidade de São Paulo, Escola de Engenharia de São Carlos, São Carlos, 2005.
PEREIRA, G. G. Remoção de células de Microcystis sp. por pré-cloração, coagulação, filtração direta e pós-cloração em escala de bancada. 2005. 95 f. Dissertação (Mestrado em Engenharia Hidráulica e Saneamento) – Universidade de São Paulo, São Carlos, 2005.
ROSARIO-ORTIZ, F.; SNYDER, S.; SUFFET, I. H. Characterization of dissolved organic matter in drinking water sources impacted by multiple tributaries. Water Research, v. 41, n. 18, p. 4115-4128, 2007.
SANT’ANNA, C. L. et al. Planktic Cyanobacteria from upper Tietê basin reservoirs, SP, Brazil. Revista Brasileira de Botânica, v. 30, n. 1, p. 1-17, 2007.
SANT’ANNA, C. L. et al. Review of toxic species of Cyanobacteria in Brazil. Algological Studies, v. 126, p. 249-263, 2008.
SENOGLES, P. et al. Degradation of the cyanobacterial toxin cylindrospermopsin, from Cylindrospermopsisraciborskii, by chlorination. Toxicon, v. 38, p. 1203-1213, 2000.
SIVONEN, K.; JONES, G. Cyanobacterial toxins. In: CHORUS, I.; BARTRAM, J. Toxic Cyanobacteria in Water: A Guide to their Public Health Consequences, Monitoring and Management. London: E & FN Spon, 1999. Cap. 3.
TUCCI, A.; SANT’ANNA, C. Cylindrospermopsis raciborskii (Woloszynka) Seenayya & Subba Raju (cianobactéria): variação semanal e relações com fatores ambientais em um reservatório eutrófico. Revista Brasileira de Botânica, São Paulo, v. 26, n. 1, p. 97-112, 2003.
VIANA, M. Avaliação de técnicas de tratamento na remoção de saxitoxinas em águas de consumo humano. 2006. 212f. Dissertação (Mestrado em Saneamento, Meio Ambiente e Recursos Hídricos) – Universidade Federal de Minas Gerais, Escola de Engenharia, Belo Horizonte, 2006.
WORLD HEALTH ORGANIZATION. WHO. Guidelines for safe recreational water environments: coast and fresh waters. WHO, 2003. v. 1, 253 p.
YANG, X.; GUO, W.; SHEN, Q. Formation of disinfection byproducts from chlor(am)ination of algal organic matter. Journal of Hazardous Materials, n. 197, p. 378-388, 2011.
ZAMYADI, A. et al. Fate of toxic cyanobacterial genera from natural bloom events during ozonation. Water Research, n. 73, p. 204-215, 2015.
ZAMYADI, A. et al. Fate of toxic cyanobacterial cells and disinfection by-products formation after chlorination. Water Research, v. 46, p. 1524-1535, 2012.
Notas de autor
